Одной из актуальных задач современной медицины является создание новых лекарственных средств, обладающих комплексным действием, минимальными побочными эффектами и практическим отсутствием противопоказаний. Это направление перспективно в ряду лекарственных средств, представляющих соединения эндогенной природы. В качестве объектов исследования нами были выбраны кислоты янтарная, фумаровая, никотиновая и глутаминовая, для усиления фармакологических эффектов которых предложено использовать экстракт прополиса, содержащий комплекс биологически – активных веществ, способных потенцировать фармакологическое действие.
Материалы и методы исследования
Первым этапом нашего исследования было изучение состава фенольных соединений прополиса [2]. Для этого мы использовали газовую хроматографию с масс – селективным детектированием. В качестве объекта исследования использовали метанольный экстракт прополиса. Определение проводили на приборе SATURN 2100 Varian. Температура нагрева газа составляла 300oC. В режиме регистрации ионов через источник пропускали гелий, а в режиме ожидания использовали азот. Масс-спектры представляли в виде полного списка относительных интенсивностей ионов в масс-спектрах с шагом 0.05 m/z и использовали для последующей обработки.
Хроматографирование методом ВЭЖХ спиртового экстракта прополиса, приготовленного методом мацерации с использованием спирта этилового 70 %, осуществляли на жидкостном хроматографе «Стайер» в обращено – фазовом режиме, используя в качестве длины волны детектирования 290 и 326 нм. В качестве подвижной фазы использовали различные варианты смеси изопропанола и воды. Использовать ацетонитрил в данном случае невозможно, так как при взаимодействии с экстрактом прополиса выпадал осадок. Скорость подачи элюента варьировала от 50 до 100 мкл в минуту. Установлено, что лучшее разделение компонентов смеси наблюдалась при использовании в качестве элюента изопропанола с водой (90:10), подкисленной кислотой уксусной в концентрации 1 %, при скорости подачи 100 мкл/минуту.
Для создания новых комбинированных лекарственных средств с препаратами, содержащими карбоксильную группу, из разных фармакологических групп целесообразно было теоретически спрогнозировать некоторые фармакологические свойства. В связи с этим было проведено компьютерное моделирование структуры полифенолов изучаемых лекарственных средств, а также их комплексов. Моделирование комплексов осуществляли при помощи программного пакета Mech [3], который использует генетические алгоритмы формирования молекулярных ассоциатов в полимолекулярных системах. Расчет вели в пересчете на рутин, апигенин, кемпферол, пиноцембрин и пиностробин, которые с достоверностью были обнаружены в результате хроматографического определения.
Для решения задачи ориентации имеется ряд подходов. В основе большинства из них – предположение о геометрическом соответствии фармакофорной части молекулы сайту рецептора. Для «укладки» в полости рецептора, как и во многих традиционных подходах, используется пространство-заполняющая модель. Ориентацию молекулы определяет весь комплекс Ван-дер-Ваальсовых, кулоновских и специфических взаимодействий с рецептором и сольватным окружением. В совокупности эти виды взаимодействий определяют молекулярное поле, которое обеспечивает комплементарность биологически активных соединений к рецептору. Следует иметь в виду, что молекула с данным видом активности содержит фрагменты, определяющие связывание с активными центрами рецептора. Эту часть молекулы можно назвать фармакофорной. Эффективность ее связывания с рецептором определяет величину активности.
Результаты исследования и их обсуждение
На основании проведенных исследований установили наличие в экстракте прополиса ряда фенольных соединений: рутин, апигенин, кверцетин, кемпферол, диметилкемпферол, кофейная кислота, феруловая кислота, коричная кислота, а также некоторые неидентифицированные вещества, 5 – гидрокси, 4, 7 – диметоксифлаванон и нафтален. Были рассчитаны некоторые хроматографические параметры (табл. 1).
Кроме того, проведена идентификация флавоноидов методом ТСХ восходящим методом. Установлено, что в системе БУВ (4:1:5) на хроматограмме экстракта прополиса после просматривания в УФ – свете и обработки хроматограммы 5 % раствором алюминия хлорида наблюдалось появление пятен с величинами Rf равными 0,44, 0,67 и 0,91. Первое пятно по величине Rf и совокупности окраски совпадало с пятном РСО рутина, а пятно с Rf = 0,91 – с РСО кверцетина. Одно пятно осталось неидентифицированным. В системе растворителей БУВ (4:3:3) наблюдается появление не менее 4 пятен с величиной Rf 0,14, 0,42, 0,69 и 0,91. Было установлено, что пятна величиной Rf 0,42, 0,69 и 0,91 соответствовали Rf СО пятен рутина, гиперозида и кверцетина, соответственно. Аналогичные данные получены при хроматографировании в системе хлороформ – спирт этиловый 95 %– вода (26:14:3). На хроматограмме наблюдалось появление трех пятен с величиной Rf, соответственно, 0,15 (неидентифицированный компонент), 0,4 (рутин) и 0,63 (кверцетин). В системе хлороформ – спирт этиловый 95 % после проявления щелочным раствором диазобензолсульфокислоты наблюдалось появление двух пятен, одно из которых с величиной Rf = 0,81 соответствовало пятну СО пиностробина, а второе (Rf = 0,89) предположительно было идентифицировано как пиноцембрин. Различные виды фармакологической активности определяли, используя программный пакет: 3D⁄4D QSAR алгоритм BiS/MC (multi-conformational) для мультиконформационного анализа биологически активных соединений, их ориентации и докинга в полостях рецептора. Абсолютная активность была принята за единицу. Результаты исследования представлены в табл. 2.
Установлено, что кислота фумаровая, янтарная и никотиновая могут обладать выраженным бактерицидным или бактериостатическим действием в отошении St. аureus. Кроме того, двухосновные карбоовые кислоты активны в отношении E. coli. При этом теоретически рассчитанная активность рутин также доказывает его антимикробное действие. Для кислоты никотиновой практически отсутствует активность в отношении кишечной палочки, а кислота глутаминовая обладает низкой активностью в отношении обоих микроорганизмов. Сочетание рутина с карбоновыми кислотами несколько снижает их эффективность. Однако при моделировании противотуберкулезной активности установлено, что в комплексах рутин – кислота никотиовая, рутин – кислота янтарная, рутин – кислота фумаровая происходит потенцирование фармакологических свойств. Все кислоты кроме глутаминовой проявляют противовоспалительную активность. При этом рутин практически инертен в модели внутреннего воспаления и подавляет активность кислоты янтарной в комплексе. Но в модели внешнего воспаления наблюдается повышение активности всех карбоновых кислот в присутствии рутина. Аналогично были проведены расчеты для комплексов с апигенином, кемпферолом, пиноцембрином и пиностробином. Результаты представлены в табл. 3 и 4.
Установлено, что карбоновые кислоты практически не оказывают влияние на фармакологическую активность апигенина и кемпферола.
Таким образом установлено, что антимикробная активность комплексов может быть обусловлена именно присутствием пиноцембрина и пиностробина в прополисе. При этом усиливается противовоспалительное действие. Для подтверждения антимикробного действия кислот янтарной, фумаровой никотиновой и глутаминовой и их композитов с экстрактом прополиса нами был проведен эксперимент in vitro в отношении штаммов микроорганизмов Staphylococcus аureus штамм 209, Escherichia coli штамм М-17, Pseudomonas aeruginosa штамм 4/1 и Candida аlbicans штамм 18/1. Исследования проводили в трех повторах [3]. Результаты представлены в табл. 5.
Таблица 1
Хроматографические параметры разделения прополиса
|
Определяемый компонент |
Время удерживания, мин. tR |
Коэффициент емкости, k/ |
Эффективность, N |
Фактор асимметрии, As |
|
Феруловая кислота |
3,5 |
0,75 |
16000 |
1,11 |
|
Апигенин |
5,7 |
1,85 |
20794 |
1,24 |
|
Кемпферол |
7,4 |
2,7 |
17978 |
1,30 |
|
Рутин |
8,9 |
3,45 |
25806 |
1,33 |
|
Пиноцембрин |
11,0 |
4,5 |
30250 |
1,33 |
|
Пиностробин |
15,4 |
6,7 |
26214 |
1,38 |
Таблица 2
Прогнозирование антимикробной и противовоспалительной активности карбоновых кислот и комплексов рутин – карбоновая кислота
|
Объект исследования |
Активность в отношении |
Противотуберкулезная активность |
Модель внутреннего воспаления |
Модель внешнего воспаления |
|
|
St. aureus |
E. coli |
||||
|
Рутин |
0,878 |
0,960 |
0,320 |
0,0846 |
0,229 |
|
Кислота янтарная |
0,343 |
0,684 |
0,247 |
0,617 |
0,200 |
|
Кислота фумаровая |
0,341 |
0,347 |
0,351 |
0,144 |
0,146 |
|
Кислота никотиновая |
0,763 |
0,001 |
0,383 |
0,231 |
0,236 |
|
Кислота глутаминовая |
0,087 |
0,005 |
0,087 |
0 |
0,012 |
|
Рутин +к-та янтарная |
0,205 |
0,199 |
0,875 |
0,017 |
0,848 |
|
Рутин + к-та фумаровая |
0,201 |
0,205 |
0,632 |
0,614 |
0,819 |
|
Рутин + к-та никотиновая |
0,156 |
0,056 |
0,943 |
0,343 |
0,457 |
|
Рутин + к-та глутаминовая |
0,121 |
0,078 |
0,227 |
0 |
0,249 |
Таблица 3
Прогнозирование антимикробной и противовоспалительной активности карбоновых кислот и их комплексов с апигенином и кемпферолом
|
Объект исследования |
Активность в отношении |
Противотуберкулезная активность |
Модель внутреннего воспаления |
Модель внешнего воспаления |
|
|
St. aureus |
E. coli |
||||
|
Апигенин |
0,327 |
0,314 |
0,260 |
0,007 |
0,065 |
|
Апигенин +к-та янтарная |
0,329 |
0,276 |
0,234 |
0,017 |
0,061 |
|
Апигенин + к-та фумаровая |
0,314 |
0,273 |
0,219 |
0 |
0 |
|
Апигенин+ к-та никотиновая |
0,267 |
0,275 |
0,341 |
0,045 |
0,112 |
|
Апигенин + к-та глутаминовая |
0,265 |
0,241 |
0,268 |
0,035 |
0,007 |
|
Кемпферол |
0,401 |
0,342 |
0,087 |
0,075 |
0,069 |
|
Кемпферол +к-та янтарная |
0,412 |
0,360 |
0,067 |
0,099 |
0,087 |
|
Кемпферол +к-та фумаровая |
0,477 |
0,401 |
0,092 |
0,088 |
0,056 |
|
Кемпферол +к-та никотиновая |
0,397 |
0,356 |
0,113 |
0,118 |
0,098 |
|
Кемпферол +к-та глутаминовая |
0,379 |
0,406 |
0,097 |
0,114 |
0,088 |
Таблица 4
Прогнозирование антимикробной и противовоспалительной активности карбоновых кислот и их комплексов с пиоцембрином и пиностробином
|
Объект исследования |
Активность в отношении |
Противотуберкулезная активность |
Модель внутреннего воспаления |
Модель внешнего воспаления |
|
|
St. aureus |
E. coli |
||||
|
пиноцембрин |
0,435 |
0,265 |
0,087 |
0,134 |
0,145 |
|
пиноцембрин +к-та янтарная |
0,679 |
0,554 |
0,116 |
0,145 |
0,348 |
|
пиноцембрин + к-та фумаровая |
0,587 |
0,601 |
0,099 |
0,123 |
0,366 |
|
пиноцембрин к-та никотиновая |
0,508 |
0,587 |
0,101 |
0,099 |
0,086 |
|
пиноцембрин + к-та глутаминовая |
0,499 |
0,501 |
0,078 |
0,101 |
0,108 |
|
Пиностробин |
0,399 |
0,351 |
0,128 |
0,207 |
0,300 |
|
Пиностробин +к-та янтарная |
0,614 |
0,588 |
0,132 |
0,099 |
0,345 |
|
Пиностробин +к-та фумаровая |
0,577 |
0,534 |
0,127 |
0,077 |
0,417 |
|
Пиностробин +к-та никотиновая |
0,558 |
0,499 |
0,171 |
0,099 |
0,422 |
|
Пиностробин +к-та глутаминовая |
0,502 |
0,488 |
0,095 |
0,068 |
0,213 |
Таблица 5
Антимикробное действие карбоновых кислот в сочетании с экстрактом прополиса
|
Определяемые вещества |
Концентрация, г/мл |
Микроорганизмы |
|||
|
E. coli |
S. aureus |
P. aeruginosa |
C. аlbicans |
||
|
Кислота янтарная |
0,05 |
- |
- |
- |
- |
|
0,005 |
+ |
+ |
+ |
+ |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
0,00005 |
+ |
+ |
+ |
+ |
|
|
Кислота фумаровая |
0,05 |
- |
+ |
+ |
- |
|
0,005 |
+ |
+ |
+ |
+ |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
0,00005 |
+ |
+ |
+ |
+ |
|
|
Кислота никотиновая |
0,05 |
- |
- |
- |
- |
|
0,005 |
- |
- |
+ |
+ |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
0,00005 |
+ |
+ |
+ |
+ |
|
|
Кислота глутаминовая |
0,05 |
- |
- |
- |
- |
|
0,005 |
- |
+ |
+ |
- |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
0,00005 |
+ |
+ |
+ |
+ |
|
|
Экстракт прополиса |
0,01 |
- |
- |
- |
- |
|
0,001 |
- |
- |
+ |
- |
|
|
0,0001 |
+ |
- |
+ |
- |
|
|
0,00001 |
+ |
- |
+ |
+ |
|
|
Смесь кислоты янтарной и экстракта прополиса |
0,05 |
- |
- |
- |
- |
|
0,005 |
+ |
+ |
- |
- |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
0,00005 |
+ |
+ |
+ |
+ |
|
|
Смесь кислоты фумаровой и экстракта прополиса |
0,05 |
- |
- |
- |
- |
|
0,005 |
+ |
- |
+ |
+ |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
Смесь кислоты никотиновой и экстракта прополиса |
0,05 |
- |
- |
- |
- |
|
0,005 |
- |
- |
+ |
- |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
0,00005 |
+ |
+ |
+ |
+ |
|
|
Смесь кислоты глутаминовой и экстракта прополиса |
0,05 |
- |
- |
- |
- |
|
0,005 |
- |
- |
- |
- |
|
|
0,0005 |
+ |
+ |
+ |
+ |
|
|
0,00005 |
+ |
+ |
+ |
+ |
|
|
Контроль культуры микроорганизмов |
+ |
+ |
+ |
+ |
|
|
Примечания: «-» – отсутствие микроорганизмов; «+» – наличие микроорганизмов |
|||||
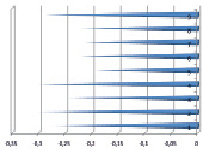
Значение энергии ВЗМО. 1 – кислота янтарная, 2 – кислота фумаровая, 3 – кислота никотиновая, 4 – кислота глутаминовая, 5 – рутин, 6 – кислота янтарная + рутин, 7 – кислота фумаровая + рутин, 8 – кислота никотиновая + рутин, 9 – кислота глутаминовая + рутин
Было установлено, что кислота янтарная в концентрации 0,05 г/мл оказывает неселективное антимикробное действие в отношении грам – положительных, грам – отрицательных бактерий и дрожжеподобных грибов, что согласуется с предварительно проведенным прогнозом. Скорее всего, это связано с тем, что в недиссоциированном виде органические кислоты являются липофильными и могут легко проникать через мембрану бактериальной клетки в цитоплазму. Оказавшись внутри клетки, где pH имеет приблизительно нейтральное значение, эти кислоты диссоциируют, высвобождая протоны. Бактерицидное действие органических кислот может также возникнуть в результате скопления анионов внутри клетки. Снижение pH внутри клетки приводит к тому, что микробная клетка использует свою энергию для выведения протонов наружу, что приводит к истощению клетки. Фумаровая кислота проявляет свою антимикробную активность только в отношении E. coli и C. аlbicans., поскольку величина показателя константы ионизации кислоты фумаровой значительно ниже, чем у янтарной. Кислота никотиновая и глутаминовая в концентрации 0,005 г/мл оказывает неселективное антимикробное действие в отношении E. coli и St. аureus и . E. coli и C. аlbicans, соответственно. При оценке антибактериальных свойств прополиса было установлено, что он обладает губительным воздействием на грам – положительные и грам – отрицательные микроорганизмы и дрожжеподобные грибы в минимальных разведениях. Было отмечено, что P. aeruginosa менее чувствительна к прополису. Для прогнозирования антиоксидантной активности карбоновых кислот и их комплексов с некоторыми флавоноидами использовали программный пакет «GAMESS», с помощью которого были рассчитаны энергии верхней занятой молекулярной орбитали (ВЗМО). Чем больше энергия ВЗМО, тем сильнее выражены восстановительные свойства соединения. Окислительные свойства, характеризуют способность соединения отдавать электрон, и тем самым обеспечивать восстановление свободно-радикального соединения или дезактивацию активной формы кислорода. Теоретически было рассчитано значение энергии ВЗМО для исследуемых кислот, а так же рутина и комплексов. Результаты представлены на диаграмме.
Установлено, что наибольшей величиной АОА обладает рутин [4]. Кислота янтарная и фумаровая также обладают некоторой активностью в отношении свободных радикалов, а кислота никотиновая и глутаминовая – лишь незначительной величиной. Однако в присутствии рутина их активность может возрастать.
Выводы
1. Хроматографически обнаружены и идентифицированы различные фенольные соединения в прополисе и экстракте на его основе.
2. Теоретически спрогнозированы некоторые виды антимикробной и противовоспалительной активности, антиоксидантный эффект.
3. Доказано наличие бактерицидного эффекта в отношении грамположительной и грамотрицательной микрофлоры.

