На сегодняшний день сахарный диабет является достаточно изученной патологией, существует множество лекарственных препаратов и современных схем терапии данного заболевания, однако, болезнь продолжает прогрессировать особенно в развитых странах [4]. По данным Всемирной Организации Здравоохранения, количество пациентов с диагностированным сахарным диабетом составляет около 160 млн., к 2025 г. прогнозируется удвоение количества пациентов с этим диагнозом. Следует отметить, что диабет является социально значимым заболеванием, поскольку сосудистые осложнения приводят к ранней инвалидизации пациентов и летальности [1, 3]. Одним из осложнений диабета является синдром «диабетической стопы». При данном состоянии наблюдается комплекс анатомо-функциональных изменений на фоне длительной гипергликемии, приводящей к развитию нейропатии, микро- и макроангиопатий, остеоартропатии, что приводит к повышенной травматизации и инфицированию мягких тканей стопы. В связи с чем, разработка мероприятий (в том числе фармакологической терапии), направленных на снижение возникновений осложнений при диабете является актуальной задачей.
Большое значение для определения вопросов патогенеза, клиники и терапии заболевания имеет экспериментальная диабетология. Экспериментальные модели диабета и его осложнений позволяют получить важные сведения не только для понимания патофизиологии заболевания, но и механизма антидиабетического действия лекарственных препаратов с целью их направленного применения [8, 10]. К настоящему времени разработан ряд моделей экспериментального диабета [11], основными из которых являются: хирургическая (полное или частичное удаление поджелудочной железы); химическая модель (используется введение химических веществ, избирательно воздействующих на b-клетки островков: аллоксан, стрептозотоцин), генетические модели (получение трансгенных животных). Моделирование «диабетической стопы», как правило, проводится на фоне стрептозотоцин-индуцированного диабета с принудительным инфицированием лапы Синегнойной палочкой (Pseudomonas aeruginosa) и Золотистым стафилококком (Staphylococcus aureus) [12, 13].
Целью данной работы стала разработка неинфекционной экспериментальной модели «диабетической стопы», с развитием ангио- и нейропатии.
Материалы и методы исследования
Исследование выполнено на 30 крысах-самцах популяции линии Wistar, полученных из питомника лабораторных животных РАМН «Рапполово».
Кормление животных осуществлялось стандартным полнорационным гранулированным комбикормом приготовленным по ГОСТ Р 50258–92. Доступ к воде и корму был свободный. Крыс-самцов содержали в поликарбонатных клетках по 5 особей, при температуре 20–22°С. Содержание животных осуществлялось в соответствии с Правилами надлежащей лабораторной практики (GLP) и Приказом Минздравсоцразвития РФ №708н от 23.09.2010 г. «Об утверждении правил лабораторной практики». Животные были разделены на контрольную (n=15) и опытную группы (n=15).
Формирование экспериментальной патологии у животных опытной группы проводили введением стрептозотоцина (Sigma, США) в дозе 60 мг/кг однократно внутрибрюшинно, спустя 15 минут после введения никотинамида (Sigma, США) в дозе 230 мг/кг (внутрибрюшинно).
С целью выявления биохимических и гистологических признаков диабета и его поздних осложнений у экспериментальных животных были проведены исследования в динамике. Концентрацию глюкозы в периферической крови измеряли глюкометром OneTouch Horizоn («Lifescan», США). Линейный диапазон измерения 1,1 – 33,3 ммоль/л. Гликозилированный гемоглобин (HbA1c) в крови определяли с использованием набора «Диабет-тест» (Фосфосорб, Россия). Метод основан на аффинной хроматографии гликозилированной и негликозилированной фракций гемоглобина в гемолизате крови. Линейный диапазон измерения 2,0 – 20,0 %. Подсчет ретикулоцитов проводился согласно унифицированной методике после их окраски готовым красителем – бриллиантовым крезиловым синим (Диахим-ГемиСтейн-РТЦ) в пробирке (суправитальный пробирочный метод).
Для гистологического и иммуногистохимического исследования материал фиксировали в 10 % растворе нейтрального формалина в течение 24 часов, и по общепринятой методике заливали в парафин [5]. Затем изготавливали срезы толщиной 5–7 мкм, которые окрашивали гематоксилином и эозином. Иммуногистохимическое исследование включало в себя определение экспрессии нейронального маркера PGP 9.5 с использованием моноклональных антител производства фирмы Abcam. Постановка реакции проводилась непрямым трехступенчатым иммуноферментным LSAB (Labeled streptavidin–Biotin, DakoCytomation, LSAB 2 System – HRP) методом визуализации; выявление пероксидазной активности осуществляли с помощью 3,3–диаминобензидина, препараты докрашивали гематоксилином Майера. Морфологическое исследование гистологических препаратов проводилось при помощи светооптического микроскопа CarlZeiss (Германия). Микрофотографирование проводили при помощи цифровой фотокамеры AxioScopeA1 (Германия).
Результаты исследования и их обсуждение
Как известно механизм действия стрептозотоцина связан с наличием в его химической структуре сахарозного остатка (гексозы), за счет которого, через транспортную систему ГЛЮТ-2, он включается β-клетками островков Лангерганса в обменные процессы вместо глюкозы. Попадая в клетку, стрептозотоцин разрушается с образованием свободных радикалов и NO·, в результате происходит алкилирование ядерной ДНК и гибель клетки [14]. Предварительное введение никотинамида приводит к снижению диабетогенного действия стрептозотоцина.
В ходе исследования было установлено, что спустя 5 недель у животных опытной группы наблюдали клинические проявления диабета, которые нашли отражение в статистически значимом увеличении концентрации глюкозы по отношению к контрольным животным более чем в 4 раза (рис. 1).
К концу исследования (14 неделя) у животных опытной группы сохранялась гипергликемия, которая дополнительно сопровождалась статистически значимым увеличением концентрации гликозилированного гемоглобина (HbA1c) более чем в 2 раза (7,4±0,1 %). Увеличение концентрации HbA1c характерно для течения гипергликемии, длительность имеет положительную корреляцию с частотой развития осложнений при диабете. Данный показатель отражает риск развития осложнений диабета.
Спустя 10 и 14 недель после моделирования экспериментального стрептозотоцин-индуцированного диабета у животных опытной группы наблюдали статистически значимое увеличение уровня ретикулоцитов более чем в 3 раза (табл. 1).
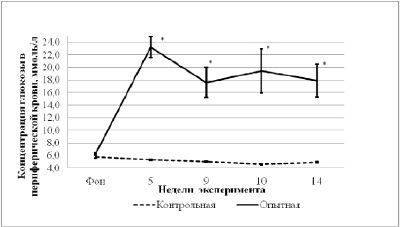
Рис. 1. Динамика изменения концентрации глюкозы в периферической крови крыс-самцов, ммоль/л
Таблица 1
Уровень ретикулоцитов в крови крыс-самцов, спустя 10 и 14 недель развития патологии, M±m (n=15)
|
Группа |
10 неделя |
14 неделя |
|
Ретикулоциты, ‰ |
Ретикулоциты, ‰ |
|
|
Контрольная |
15,5±1,4 |
14,2±1,7 |
|
Опытная |
55,6±14,2* |
57,0±5,4* |
* – различия статистически значимы по сравнению с контрольной группой (р<0,05).
На фоне хронического диабета в тканях возникает дефицит кислорода и компенсаторно происходит увеличение эритропоэза [6, 7], что сопровождается выходом в системный кровоток молодых эритроцитов и ретикулоцитов. Уровень ретикулоцитов в периферической крови при окислительном стрессе отражает степень гипоксии тканей [2, 9].
Гистологическая оценка подтвердила наличие изменений характерных для диабетической патологии. В опытной группе наблюдали типичные проявления микроангиопатии, характерные для отсроченных осложнений диабета (рис. 2–6). У животных данной группы наблюдали продуктивный капиллярит со слабо выраженным периваскулярным склерозом, а также склероз стенок артериол. В тканях выявляли периваскулярную лимфо-гистиоцитарную инфильтрацию от слабой до умеренной выраженности, частично затрагивающую периневральные зоны. Кроме того была выявлена аксональная дегенерация, демиелинизация и очаговый некробиоз аксонов. Трофические нарушения приводили к дистрофическими нарушениям в дерме, где отмечался выраженный гиперкератоз и слабо выраженный акантоз, местами с вовлечением в процесс придатков кожи (волосяных фолликулов, сальных и потовых желез). Патологический процесс частично затрагивал костно-суставную структуру в виде дистрофических изменений хрящевой ткани. В тканях крыс-самцов контрольной группы отличий от нормы не выявлено.
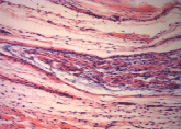
Рис. 2. Аксональная дегенерация и очаговый некробиоз аксонов в нервном стволе. Окраска гематоксилином и эозином. Увеличение 200
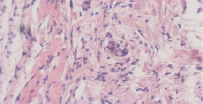
Рис. 3. Умеренно выраженная диффузная лимфоплазмоцитарная инфильтрация, преимущественно переваскулярных и переневральных зон, соединительнотканные «муфты» в переневральных зонах (стрелка). Увеличение 200
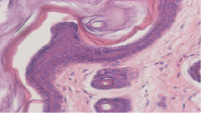
Рис. 4. Выраженный гиперкератоз и слабо выраженный акантоз, вовлечение в патологический процесс придатков кожи (волосяных фолликулов). Окраска гематоксилином и эозином. Увеличение 200
При иммуногистохимическом исследовании с применением маркера PGP 9.5 в опытной группе крыс-самцов наблюдали диабетическую нейропатию, которая выражалась в снижении плотности нервных волокон за счет аксональной дегенерации, демиелинизации и очагового некробиоза (рис. 5). В контрольной группе животных отличий от нормы не выявлено (рис. 6).
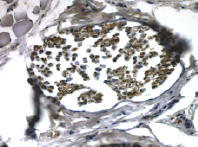
Рис. 5. Кожа стопы крысы контрольной группы. Нервные волокна без отклонения от нормы. Иммуногистохимическое окрашивание. Экспрессия нейронального маркера PGP 9.5 в осевых цилидрах. Увеличение 200
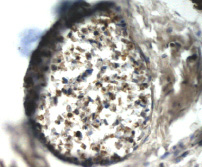
Рис. 6. Кожа стопы крысы опытной группы. Нервные волокна с очагами демиелинизации, дегенерации тигроидной субстанции осевых цилиндров. Иммуногистохимическое окрашивание. Снижение экспрессии нейронального маркера PGP 9.5 в осевых цилидрах. Увеличение 200
Таким образом, данные гистологического и иммуногистохимического исследования подтверждают развитие ангио- и нейропатий у лабораторных животных.
Выводы
Биохимические исследования крови лабораторных крыс-самцов с модельной патологией стрептозотоцин-индуцированного диабета выявили стойкие изменения углеводного обмена (гипергликемия (концентрация глюкозы в крови опытных животных находилась в диапазоне 17–23 ммоль/л), повышение концентрации HbA1 (в два раза по сравнению с контрольной группой)), увеличение уровня ретикулоцитов более чем в 3 раза, свидетельствующие о развитии диабета у животных.
Спустя 14 недель исследования у лабораторных животных определяются структурно-морфологические изменения, свидетельствующие о развитии ангио- и нейропатии.
Модель длительно-текущего стрептозотоцин-индуцированного диабета может быть рекомендована для изучения специфической активности новых препаратов, для терапии отсроченных осложнений диабета.

