В настоящее время серьезной проблемой является загрязнение природных вод промышленными стоками, что ухудшает экологическую обстановку. Сточные воды, как правило, представляют собой сложные гетерогенные системы, содержащие неорганические и органические вещества, находящиеся в растворенном, коллоидном и нерастворенном состояниях. Основной вклад в загрязнение вносят гальванические и травильные производства. Эти производства требуют большого количества воды [4] для промывки обрабатываемых деталей, в результате чего происходит сброс большого количества отходов [5]. В связи с этим ведется поиск эффективных и экологически выгодных методов очистки сточных вод от цветных и тяжелых металлов.
Каолинит как природный минерал известен давно [1], является главным составляющим всех глин. Основа – это водные алюмосиликаты Al4[Si4O10][OH]8 с небольшими примесями железа (III), магния, кальция, натрия, калия. Для каолинита характерна триклинная сингония a0 = 5,14; b0 = 8,90; c0 = 14,45; β = 100°12' [1]. Цвет минерала от белого, нередко с желтым, буроватым, красноватым, иногда зеленоватым или голубоватым оттенком. Твердость около 1 по десятибалльной шкале. Удельный вес в пределах 2,58 – 2,60 г/см3. Каолинит не плавится, устойчив к HCl и HNO3, но при нагревании с H2SO4 легко разлагается. При нагревании выше 300° каолинит полностью разрушается.
В последнее время глинистые минералы являются объектами многочисленных исследований [2, 3, 6] с использованием местного сырья для решения региональных экологических проблем. Это связано с очисткой сточных вод различного происхождения. Использование местного сырья для извлечения цветных металлов из сточных вод характеризуется высокой экономичностью и малым расходом сорбента.
Целью настоящей работы является исследование сорбции ионов меди на модифицированном природном сорбенте. Используемый в работе калионит имеет следующий химический состав,%: SiO2 – 43,98; Al2O3 – 18,73; Na2O – 0,96; K2O – 0,80; CaO – 0,06; Fe2O3 – 6,32; силикатный модуль SiO2/Al2O3 составляет 2,35. Характер сорбционного процесса ионов меди изучали на четырех формах каолинита. Использовали каолинит в нативной (природной форме) и химически модифицированной: Н-форма (каолинит обработан соляной кислотой); солевая Na-форма (обработан NaCl); ОН-форма (обработан гидроксидом натрия).
Сорбцию катионов меди изучали в статических условиях из нитратных растворов с концентрациями 0,01; 0,02; 0,04; 0,06; 0,08 и 0,1 моль/л. Значение рН растворов в контакте с сорбентом во всех случаях не превышало 6,7.
Перед проведением эксперимента каолинит был рассеян на фракции. Для исследования использовали фракцию частиц размером 2,5 – 3,5 мм. Эксперименты проводили при температурах 298, 318, 333 К с использованием термостатированного шкафа с точностью ± 1 К.
В процессе извлечения Cu2+ происходит изменение его концентрации в растворе и в адсорбенте. Сорбцию ионов меди в статических условиях проводили методом переменных концентраций. Для этого сорбент в соответствующей ионной форме помещали в виде отдельных навесок массой 1,0 г в колбы с притертыми пробками на 100 мл. Каждую колбу с навеской сорбента заливали 50 мл раствора, содержащего исследуемый ион различной концентрации. Сорбент в контакте с исследуемым раствором выдерживали в течение 7 суток при соответствующей температуре. Затем отбирали аликвоты и определяли содержание поглощенных ионов по разности между концентрациями исходного и равновесного растворов. Концентрацию ионов меди в растворах определяли комплексонометрическим титрованием с индикатором ПАН в среде ацетатного буфера.
Статическую обменную емкость (Г, ммоль/г) рассчитывали по уравнению:
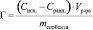
где Сисх. – исходная концентрация ионов меди и цинка в растворе, ммоль/л; Сравн. – равновесная концентрация ионов меди и цинка, ммоль/л; Vр-ра – объем раствора, л; mсорбента – масса сорбента, г.
В результате было установлено, что с увеличением концентрации ионов меди возрастает величина удельной сорбции. Полученные данные показывают, что солевая, щелочная и кислотная обработка каолинита приводит к увеличению сорбируемости ионов меди, по отношению к исходному сорбенту. Сорбционная емкость в солевой форме – 15,8; щелочной – 12,0; кислотной – 9,6; исходной – 7,4 ммоль/г.
У исходного каолинита, по-видимому, имеет место блокировки его активных центров. С увеличением концентрации сорбция на исходном каолините возрастает и в области 0,2 ммоль/л наблюдается перегиб, указывающий на изменение механизма сорбции. На первой ступени сорбции меди предельное значение не достигается и выше отмеченной концентрации сорбция проходит одновременно на различных активных центрах. Сорбция проходит по ионообменному механизму.
В заключении следует отметить, что каолинит в солевой форме обладает более высокой сорбционной способностью по отношению к ионам меди по сравнению с нативной формой каолинитом.
По величине сорбционной способности каолинит в разных формах можно расположить в ряд: Na-форма > ОН-форма > Н-форма > нативная форма каолинита.

