На сегодняшний день фосфорная промышленность испытывает дефицит качественного фосфатного сырья. В связи со снижением содержания основных компонентов в фосфоритах бассейна Каратау, невыгодной становится переработка большой части сырья по традиционным технологиям. Это обусловлено образованием большого количества отходов при переработке сырья низкого качества. Кроме того, на юге Республики накоплено значительное количество отходов фосфорного производства, которые по содержанию Р2О5 не уступают фосфоритной муке Каратау, и вовлечение их в производство фосфорных удобрений является также актуальной задачей, которое кроме расширения сырьевой базы, решает ряд экономических и экологических проблем региона.
Цель исследования
Целью исследования является переработка фосфоритов Каратау на экологически чистые фосфорные удобрения.
Материалы и методы исследования
В работе были применены следующие методы исследования:
1) фотоколориметрический метод;
2) рентгенофазовый анализ.
Результаты исследования и их обсуждение
Поиск новых технологических решений, позволяющих переработать низкокачественные фосфориты на удобрения с высоким содержанием усвояемого растениями Р2О5, является одной из актуальных проблем казахстанских предприятий фосфорной подотрасли.
Одним из таких методов является механохимическая активация фосфатных руд с получением готового удобрения [1-2]. Преимуществом механохимического метода является возможность использования растворов, солей и других веществ, которые неэффективны при обычной химической обработке, но вступают во взаимодействие с фосфатом в процессе сверхтонкого измельчения.
В ранее проведенных нами исследованиях показано [3-4], что добавки серы с разбавленными минеральными кислотами в качестве активирующей добавки к фосфатам при их диспергировании способствуют структурным изменениям и увеличению содержания усвояемых фосфатов в конечных продуктах. Выявлено, что температура и модифицирующие добавки, вводимые с природными фосфоритами Каратау в процессе их диспергирования, приводят к структурно-молекулярным преобразованиям фосфатной составляющей сырья.
При механической активации фосфорита в мельнице было достигнуто максимальное удаление фтора и карбонатов [5].
На наш взгляд, наиболее актуальными представляются исследования, направленные не просто на механохимическую активацию природных фосфатов, а на создание системы измельчения, основанной на новом принципе комбинированного воздействия, сочетающем механическое воздействие со стороны аппаратов ударноимпульсного действия с турбулизацией среды поверхностными электромагнитными полями [6].
Наиболее распространенным и эффективным способом передачи энергии в процессах измельчения является ударное воздействие, так как именно оно позволяет концентрировать механическую энергию в определенных участках обрабатываемого тела в количествах, необходимых для его разрушения. Ударные воздействия реализуются в большинстве конструкций современных измельчительных аппаратов: дезинтеграторах, шаровых, струйных, вибрационных, молотковых, планетарных, ударно-дисковых и др. типах мельниц.
В материалах, диспергированных в аппаратах ударно-импульсного действия, накопленная в них энергия проявляется в повышении химической активности, снижении температуры плавления, спекания, термической диссоциации и других физико-химических явлениях. Эти изменения, накапливаясь и локализируясь в определенных объемах, приводят к разрушению твердых тел.
Фосфориты в обычных условиях фактически инертные к углекислому газу, при определенных режимах механической обработки за счет протекания механохимических процессов в больших количествах, сопоставимых с массой измельчаемого образца, селективно поглощают СО2 из окружающей среды. Углекислый газ гомогенно, на молекулярном уровне, «растворяется» в структурно разупорядоченной оксидной матрице в виде карбонатных ионов. Особенностью обнаруженного эффекта является то, что он не связан с поверхностной сорбцией газа или механохимическим превращением исходных соединений в карбонаты. Измельчение или целенаправленная механическая активация сопровождаются сорбцией молекул воды и других газов из окружающей среды на поверхности обрабатываемых веществ, что воздействует на их реакционную способность. Механизм поглощения газов и влияние этого процесса на физико-химические свойства измельчаемых твердых тел до сих пор во многом остаются неясными. Актуальность детальных исследований в этой области связана, в частности, с возможностью целенаправленной модификации наружных слоев частиц путем контролирования атмосферы в мельнице и регулирования таким способом технологических свойств измельчаемых веществ. Данное исследование направлено на изучение новых физико-химических процессов с участием диоксида углерода и связано со структурно-химическими изменениями в фосфоритах Каратау при механохимическом взаимодействии с СО2. Начальный этап исследования связан с тем, что при истирании в механической ступке образцов фосфорита Каратау была обнаружена их необычная способность селективно поглощать углекислый газ воздуха в количествах, многократно превышающих поверхностную сорбцию газов. Поглощенный СО2 находится в МА-образцах в виде карбонатных ионов, сопоставимых с содержанием Са и Mg в минерале.
В наших экспериментах фосфорит Каратау поглощает углекислый газ из воздуха при комнатной температуре и естественном парциальном давлении Р(СО2) = 30 Па. Для выяснения предельного количества углекислого газа, которое может поглотить минерал, был проведен опыт по механической обработке фосфорита в контролируемой атмосфере СО2 на установке, собранной на базе виброистирателя, и снабженной датчиком давления. Экспериментально установлено, что активация в течение 60 час в атмосфере СО2 в виброистирателе приводит к поглощению 20,5 мас. % СО2, после чего процесс поглощения практически прекращается. Согласно данным РФА, полученный образец являлся полностью рентгеноаморфным.
Конструкция аппарата РМ-200 позволяла контролировать давление во время активации в рабочем барабане, который перед экспериментом заполняется соответствующим газом и герметично изолируется от внешней среды. Перед началом эксперимента аппарат был вакуумирован с помощью форвакуумного насоса, затем заполнен диоксидом углерода из баллона, предварительно пропущенным через трубку с силикагелем. Количество поглощенного СО2 рассчитывалось из падения давления внутри аппарата по показаниям вакуумметра. На рис. 1 приведены данные по кинетике поглощения СО2 в ходе активации фосфорита Каратау.
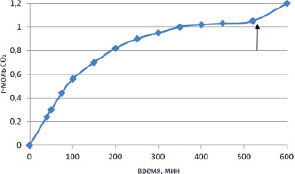
Рис. 1. Зависимость количества молей поглощенного углекислого газа на один моль Са5-(РО4)3 от времени активации фосфорита в среде СО2 в аппарате РМ-200 (Retsch)
Зависимость соотношения усваиваемого Р2О5 к общему от исходного содержания воды в фосфатном сырье
|
Зависимость соотношения усваиваемого Р2О5 к общему от исходного содержания воды в фосфатном сырье |
||||||||
|
Р2О5ус./ Р2О5об. |
0,51 |
0,58 |
0,68 |
0,73 |
0,76 |
0,77 |
0,78 |
0,78 |
|
Н20 % |
1,5 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
Из рис. 1 видно, что с увеличением степени карбонизации фосфорита и уменьшением давления СО2 в системе скорость его поглощения фосфоритом падает. Вместе с тем, после 520 мин механической активации кривая еще не выходит на плато, поскольку после того, как систему вновь заполнили СО2 до атмосферного давления (показано стрелкой на рис. 1), скорость поглощения углекислого газа возросла. Исходя из линейной временной зависимости функции (-ln (1- α )), где α – отношение количества молей поглощенного СО2 к его исходному содержанию в системе, видно, что в течение первых 140 минут активации реакция формально имеет первый порядок по концентрации СО2 (рис. 2).
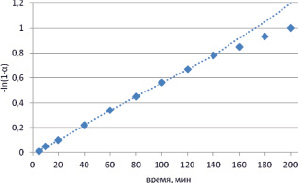
Рис. 2. Зависимость функции (-ln(1– α) от времени активации фосфорита Каратау в атмосфере СО2 в аппарате РМ-200 (Retsch), где α – отношение количества молей поглощенного диоксида углерода к его общему содержанию в системе
Скорость поглощения СО2 зависит как от концентрации (давления) диоксида углерода в системе, так и от величины свежеобразованной поверхности в единицу времени. По-видимому, в первые 140 минут активации скорость образования свежей поверхности практически постоянна. В дальнейшем она уменьшается, что приводит к отклонению функции (-ln (1-α)) от линейной (рис. 2).
Экспериментальные данные на переход соединений фосфора в усваиваемую растениями форму при обработке углекислым газом при парциальном его давления 1 атм. в течении трех часов при перемешивании и температуре 85 °С приведены в таблице.
В качестве естественного фосфатного сырья использовали Каратауские фосфориты стандартного помола (остаток на сите с размером отверстий 0,15 мм не более 14 %), содержащий 22,3 % Р205. Из приведенных данных, оптимальным содержанием воды в фосфатном сырье при разложении его углекислым газом является концентрации 20...30 %, при такой концентрации образуется продукт с высоким содержанием соединений фосфора в форме, которая усваивается растениями.
В соответствии с современными термодинамическими представлениями, конверсия фосфорита угольной кислотой проходит через стадию образования хорошо растворимого гидрокарбоната кальция (166 г/л при 20 °С):
Са10F2(РО4)6. тв + 3 Н2СО3 = = 6СаНРО 4.тв + 3Са(НСО3)2 р. + СаF2.тв (1)
Энергия Гиббса и энтальпия этой реакции ∆G298 = – 1590,5 и ∆Н = – 2123,6 кДж/моль. Снижение парциального давления СО2, сушка продуктов реакции 3 приводит к образованию карбоната кальция:
Са(НСО3)2р. = СаСО3.тв + Н2Ог. + СО2 г. (2)
Энергия Гиббса и энтальпия этой реакции ∆G298 = – 22,2; ∆Н298 = + 93,6 кДж/моль. Реакция вероятна и проходит с поглощением тепла.
При этом анион угольной кислоты реагирует с кальцием (магнием), связывает его и тем самым способствует повышению доступности растениям фосфора обрабатываемого фосфорита. Образующийся при этом осадок и СО2 стабилизируют состояние суспензии. Суспензия активированной фосфоритной муки в отличие от традиционной фосфоритной муки не пылится и хорошо дозируется (тонина помола фосфоритной муки по европейским стандартам должна составлять 0,063 мм). Фтор в конечном продукте находится в виде СаF2, растворимость которого не превышает предельно допустимую концентрацию фтора в воде.
Первая константа угольной кислоты К1 = 4,5.10-7, что соответствует рН = 3,18. Дикальцийфосфат (преципитат) СаНРО4 – фосфорное удобрение, кислая соль ортофосфорной кислоты, рН водной вытяжки этой соли равно 3,60 – выше, чем достигается при использовании угольной кислоты. Вторая константа угольной кислоты К2 = 4,7.10-11, что соответствует рН = 5,17. Как видно из рис. 3, возможное рН растворов солей угольной кислоты находится в пределах существования дикальцийфосфата, который является отличным фосфорным удобрением пролонгированного действия.
Данные приведенной диаграммы можно интерпретировать как возможность взаимодействия природных фосфатов со слабыми кислотами, в частности, с угольной. Константа диссоциации этой кислоты Кдис = 4,5.10-7, что соответствует рН = 4,6. Из приведенной диаграммы следует, что принципиально возможно разложение фосфатного сырья угольной кислотой в дикальцийфосфат, который усваивается растениями, то есть может быть использован как фосфорное удобрение.
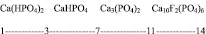
Рис. 3. Диаграмма областей существования фосфатов кальция при различных рН
Выводы
Замена сильных минеральных кислот при разложении активированного фосфатного сырья на угольную кислоту, что будет способствовать структурным изменениям, приводит к увеличению содержания усвояемых форм фосфатов в конечных продуктах.
Использование угольной кислоты позволяет получать экологически чистые удобрения пролонгированного действия на 5-7 лет практически для любых по кислотности почв.
Механически активированные фосфаты и слабая угольная кислота не повышают кислотности почв, они являются мелиорантами, улучшающими структуру почв, понижают их кислотность.

