В результате ранее проведенных исследований было установлено, что N-арилзамещенные аминопирролидоны, проявляют фунгицидную и рострегулирующую активность [1]. В связи с этим, перспективным является исследование новых синтетических возможностей N-арилзамещенных пирролин-2-онов[2, 3].
Исследование структуры 1-(4-нитрофенил)пирролин-2-она (I) методом дипольных моментов и квантово-химический расчет показали, что следует ожидать возможность протекания реакций по нескольким реакционным центрам, и синтетические возможности этих соединений не исчерпаны [4]. Наиболее доступным исходным сырьем для этих целей является 1-(4-нитрофенил)пирролин-2-он и синтезированные в реакциях радикального присоединения гидроксиалкилпирролидоны [5]. Синтез ранее не известных соединений на их основе позволит и в дальнейшем расширять ассортимент химических реактивов, а возможно и биологически активных соединений.
Были проведены реакции взаимодействия N-арилзамещенных пирролин-2-онов с алифатическими, алициклическими и ароматическими аминами.
Исследование реакционной способности 1-(4-нитрофенил)пирролин-2-она (I) и 1-(4-сульфамонилфенил)-5Н-пирролин-2-она (II) с бутил-, фенил- и бензиламинами (схема 1) первоначально проводили при комнатной температуре в избытке амина, который использован в качестве реагента и растворителя [6].
Образование N-замещенных амидов 3-N-алкил(бензил)аминобутановой кислоты отмечено на 7-е сутки, а при выдерживании реакционной смеси до 15 суток наблюдается количественный выход соединений III-VII.
С целью увеличения скорости протекания реакции изменяли температурный режим, нагревая от 45 ± 2 °С до 70 ± 2 °С. Однако, при 70 °С наблюдается сильное осмоление реакционной массы.
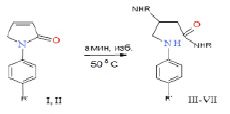
R = NO2 (I), R = CH2C6H5 (III), С6Н5 (IV), C4H9 (V)
R = SO2NH2 (II), R = CH2C6H5 (VI), C4H9 (VII)
Найдены оптимальные условия для получения целевых продуктов– постепенное добавление пирролинона к избытку амина, используемого и в качестве растворителя, и в качестве реагента, при интенсивном перемешивании и нагревании в течение 6 часов при температуре не более 50 ± 2 °С с последующим выстаиванием реакционной смеси до полной кристаллизации.

