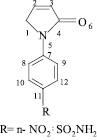
Исходя из структуры пирролинонов, следует ожидать возможность протекания реакций по нескольким реакционным центрам, а синтетические возможности этих соединений не исчерпаны [1– 4]. N-замещенные производные пирролидонов обладают рострегулирующей и антистрессовой активностью [5]. На современном этапе развития органического синтеза широко используются квантово-химические методы расчетов параметров органических молекул для предопределения их реакционной способности. Проведенные исследования показывают высокую реакционную способность N-арилзамешенных пирролин-2–онов в реакциях присоединения по двойной связи пирролинонового кольца, в реакциях радикального, нуклеофильного присоединения, что уже подтверждено экспериментальными данными [6,7]. Исследование структуры 1–(4–R-фенил)пирролинона проведено методом дипольных моментов и квантово-химический расчетом по методу MNDO.
|
R |
Заряд атома |
||||
|
С(1) |
С(2) |
С(3) |
С(4) |
N(5) |
|
|
NO2 |
0,175 |
–0,069 |
–0,109 |
0,387 |
–0,398 |
|
SO2NH2 |
–0,023 |
–0,135 |
–0,195 |
0,334 |
–0,300 |
Рассчитанный дипольный момент молекулы пирролинона оказался выше экспериментального. Различия в рассчитанном и экспериментальном дипольном моменте связаны с тем, что при расчетах не было учтено нарушение компланарности молекулы. Полученные расчеты показали, что атом азота принимает участие в сопряжении не только с R-фенильным фрагментом, но и с атомом кислорода карбонильной группы. Сравнение величин зарядов на атомах углерода пирролиноновых циклов молекул исследуемых пирролин-2-онов (таблица) показывает незначительное влияние на них заместителя в n- положении бензольного кольца.

