Эффект влияния низкоинтенсивного электромагнитного излучения на процессы управления гомеостазом широко обсуждается в литературе. Этот эффект связывают с возможностью «полевого переноса» биоинформации и является основой для создания принципиально новых технологий немедикаментозного лечения и коррекции физиологического состояния организма [2]. Физиологическое (функциональное) состояния организма служит отражением специфических форм интеграции ритмов мозга с осцилляциями эндогенной природы, а определение явления синхронизации осцилляторной активности в различных зонах головного мозга является удобным инструментом выявления всех компонентов системы. Сегодня частотные составляющие ЭЭГ рассматриваются скорее не как фон, оказывающий модулирующее влияние на функциональное состояние ЦНС, а как мозговой механизм, включенный в реализацию адаптивных процессов, протекающих с участием ЦНС. Однако, не ясен ни сам механизм генерации осцилляций, ни способы, которыми осцилляции включаются в регуляторные процессы ЦНС [6].
Так, даже одноразовое экзогенное КВЧ-воздействие слабой интенсивности при особых параметрах модуляции может оказывать выраженное действие на функциональное состояние нейронов коры головного мозга, которое определяется как степенью участия резонансных и адаптационных механизмов ЦНС, так и формированием следовых процессов в активности корковых нейронов [8]. Из этого следует, что центральные механизмы биоинформационного воздействия ЭМИ объединяют совокупность процессов неспецифической регуляции активности корковых нейронов, что может играть немаловажную роль при различных патологических состояниях, в том числе, при онкопатологии.
В мировой литературе накоплен огромный материал о патологических изменениях в центральной нервной системе при опухолевом росте [1, 5]. Что же касается компенсаторных реакций и восстановительных процессов в нервной системе, доказывающих физиологическую адекватность и эффективность новых технологий противоопухолевой терапии, то данные о них можно встретить крайне редко. Именно в этом направлении представляется актуальным исследование механизмов, обеспечивающих стабильную работу головного мозга, как высшего отдела нервной системы, что во многом предопределяет качество жизни онкологических больных.
Целью работы стала оценка возможности и характера компенсаторных изменений биоэлектрической активности мозга и интегральных адаптационных реакций у больных раком легкого после хирургического лечения с применением послеоперационной магнитотерапии. Дизайн исследования включал изучение особенностей биоэлектрической активности мозга больных раком легкого, получающих магнитотерапию в раннем послеоперационном периоде. Мониторинг ЭЭГ проводился параллельно с исследованием динамики электрокожного сопротивления в 2-х парах биологически активных точек гипоталамуса и точках стандартного измерительного профиля, по методу электроакупунктуры Р. Фолля. Кроме того представлялось целесообразным изучение структуры адаптационных реакций у онкологических больных на этапах комплексного лечения с применением сверхнизкочастотного переменного магнитного поля (СНЧ МП) и проведение сопоставительного анализа показателей пространственной синхронизации корковых биопотенциалов мозга больных раком легкого с характером различных общих адаптационных реакций.
Материалы и методы исследования
Для оценки действия магнитотерапии были использованы результаты обследования 25 больных раком легкого. По возрастным характеристикам, стадиям опухолевого процесса, а также объему выполненных операций основная и контрольная группы больных существенно не отличались. Воздействие СНЧ МП применяли ежедневно, начиная со второго дня после операции. В качестве источника электромагнитного поля использовали магнитотерапевтический аппарат «Спектр-2» с микропроцессорным управлением. Индуктор аппарата устанавливали на затылочную область головы в соответствии с локализацией фокуса максимальной активности альфа-ритма [10]. Применяли СНЧ МП с синусоидальной формой импульса и последовательностью частот, близких к диапазону эндогенных ритмов головного мозга с соблюдением следующего частотно-временного режима: 0,03 Гц – 5 мин; 0,3 Гц – 3 мин; 9 Гц – 1 мин с фиксированной индукцией. Начальная величина индукции составляла 4,6 мТл и затем постепенно с интервалами в 2–3 дня снижалась в экспоненциальном режиме до 0,5 мТл.
Для регистрации ЭЭГ использовали анализатор электрической активности мозга «Энцефалан-131-01» фирмы «Медиком МТД» (г. Таганрог). Результаты спектрального компьютерного анализа были получены на основе Фурье-преобразования клинически значимых ритмов мозга: альфа-, бета-, тета- и дельта-диапазонов частот. Изучали амплитудные характеристики, представленность (индекс) каждого ритма в ЭЭГ обследованных больных, а также характеристику зонального распределения альфа-ритма. Уровень пространственной синхронизации определяли по коэффициентам кросскорреляций (КК), рассчитанным для 16-ти внутри- и межполушарных пар отведений: фронтальных (F), центральных (C), височных (Т) и затылочных (О). Для анализа были выбраны альфа- и бета-диапазоны частот. Показатель общего уровня синхронизации биопотенциалов определяли, суммируя КК, рассчитанные для всех 16 пар отведений. Кроме того, проводили анализ межгрупповых отличий отдельно для каждой изучаемой пары отведений.
Для проведения замеров по методу электроакупунктуры Р. Фолля (ЭАФ) использовали рефлексодиагностический комлекс «Риста-ЭПД», (г. Таганрог). Производили измерения показателей вызванной электропроводности (сопротивления) в биологически активных точках кожной поверхности. Обследование проводили, пользуясь стандартным измерительным профилем для ЭАФ и на 4-х точках гипоталамуса. Результат взаимодействия «раздражитель–рецептор» регистрировали в условных единицах (у.е.).
Для идентификации типа общих неспецифических адаптационных реакций (ОНАР) использовали лейкограмму Шиллинга, подсчет которой производили на 200 клетках в мазках периферической крови, окрашенных по Романовскому-Гимза [4]. Устанавливали общегрупповую структуру реакций у больных в сравниваемых группах и рассчитывали коэффициент соотношения антистрессорных и стрессорных реакций, как синтетический показатель, отражающий качество состояния организма[9]. Исследование структуры адаптационных реакций проводили за сутки до операции, а также на 7-е и 14-е сутки после нее. Полученные данные обрабатывали методом математической статистики с использованием программы «Statistiсa 6.0». Достоверность различий показателей определяли по t-критерию
Стьюдента.
Результаты исследования
и их обсуждение
Анализ зональных различий, т.е. проекции альфа-ритма в кору мозга, показал, что к концу курса лечения с применением СНЧ МП количество больных с нормальным зональным распределением альфа ритма возросло на 25 %, а с нарушенным снизилось на 15 %. В контрольной группе больных, напротив, количество ЭЭГ с нормальными характеристиками зональных различий снизилось почти в 2 раза (с 63 до 38 %), а с нарушенными возросло с 37 до 62 % (рис. 1).
Таким образом, разнонаправленная динамика зонального распределения основного ритма ЭЭГ свидетельствовала о выраженном протектирующем действии СНЧ МП и улучшении функционального состояния коры мозга.
При сравнении изучаемых характеристик бета-ритма нормальной амплитуды нами было выявлено, что в группе с послеоперационной магнитотерапией (ПО МТ) его мощность возрастала с 71 до 141 у.е. (рис. 2).
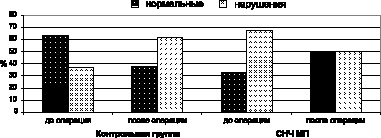
Рис. 1. Влияние послеоперационной магнитотерапии на основной ритм ЭЭГ
(по оценке сохранности и нарушений зональных различий)
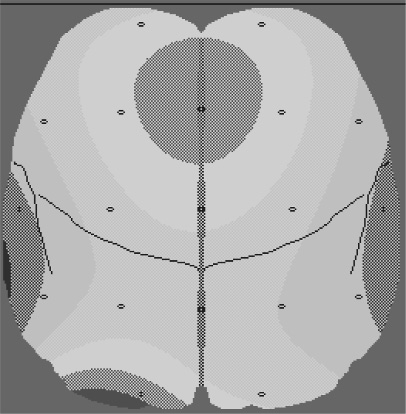
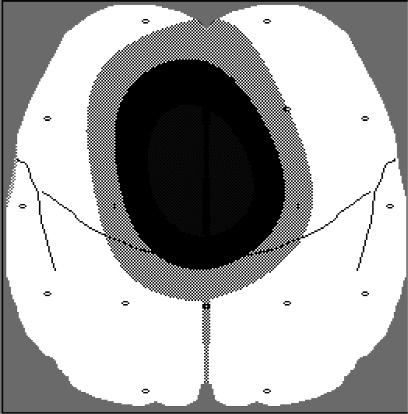
а б
Рис. 2. Динамика мощности бета-ритма у больных раком легкого:
а – до операции; б – после применения СНЧ МП (мощность бета-ритма возросла)
Такой рост мощности происходил за счет увеличения представленности ритма в записи ЭЭГ при стабильном значении амплитуды. У больных, не получавших электромагнитное воздействие, спектральная мощность бета-ритма оставалась неизменной. Увеличение удельного веса этого частотного диапазона в ЭЭГ многие авторы связывают с активационными процессами в коре. Полученный результат, по нашему мнению, свидетельствует о лучшей сохранности мозговых функций у больных, получавших электромагнитное воздействие, в отличие от больных контрольной группы. Анализ характеристик тета-ритма показал, что в основной группе к концу курса ПО МТ его мощность не изменилась. В контрольной группе больных прирост мощности этого ритма по сравнению с исходным значением составил 57 %, что коррелирует у онко-логических больных с усилением вегетативной лабильности. При рассмотрении динамики мощности дельта-ритма в процессе лечения нам удалось установить, что в сравниваемых группах она была противоположной. Так, в группе больных, получавших ПО МТ, она снизилась на 14 %, а в контрольной группе – повысилась на 15 %. Как известно, повышение мощности этой полосы спектра свидетельствует о снижении функциональной активности коры больших полушарий, а также является следствием ухудшения кислородного обеспечения. Таким образом, применение магнитотерапии создает альтернативную динамику медленноволновой активности мозга, предотвращая ослабление процессов гомеостатической регуляции.
При изучении пространственной синхронизации корковых биопотенциалов было установлено, что значения КК между некоторыми зонами коры к концу курса лечения в основной группе больных были достоверно выше, чем в контрольной. Так, в альфа-диапазоне частот достоверная разница среднегрупповых значений показателя синхронизации была выявлена для симметричных центрально-височных пар отведений правого (0,78 ± 0,05 в контрольной группе и 0,88 ± 0,02 – в основной, р < 0,05) и левого (0,72 ± 0,08 и 0,91 ± 0,03 соответственно, р < 0,05) полушарий. Между симметричными височными отведениями наблюдалось аналогичное соотношение значений показателя синхронизации в сравниваемых группах, однако только на уровне тенденции (р < 0,1). Анализ пространственной синхронизации в бета-диапазоне показал достоверность отличий между группами по изучаемому показателю в парах симметричных центральных (0,15 ± 0,09 в контрольной группе и 0,38 ± 0,06 – в основной, р < 0,05) и височных (0,41 ± 0,04 и 0,54 ± 0,05 соответственно, р < 0,05) отведений, а также в затылочно-височной паре правого полушария (0,06 ± 0,04 и 0,25 ± 0,05 соответственно, р < 0,05). Выявленные особенности динамики этого показателя в паре височных отведений для бета-ритма позволили нам предположить, что тенденция к усилению синхронизации между зонами височной коры, наметившаяся в альфа-диапазоне частот после проведения курса ПО МТ, не была случайной. Направленность к симметризации значений КК, а также к усилению пространственной синхронизации корковых процессов между симметричными участками коры больших полушарий, на наш взгляд, является закономерным отражением оптимизации мозговых процессов, вызванной электромагнитным воздействием.
Установлено, что в условиях применения послеоперационной магнитотерапии наблюдаемые компенсаторно-восстановительные процессы корковой биоэлектрической активности мозга больных раком легкого коррелируют соответственно со стабилизацией и уменьшением в 1,8 раза частоты асимметрий значений электрокожного сопротивления в 2-х парах контрольно-измерительных точек гипоталамуса (по Р. Фоллю), что может свидетельствовать об определенном улучшении высшей вегетативной регуляции организма [7]. Это подтверждалось состоянием биоадаптивных интегральных реакций.
В группе пациентов, которым применялось ПО МТ, на 14-е сутки послеоперационного периода наблюдалось формирование устойчивых физиологических антистрессорных реакций тренировки и активации. При этом доминирующим типом в структуре АР была спокойная активация. Межгрупповые различия отразились также в неодинаковом соотношении антистрессорных реакций и стресса (К АС/С). Стремительная динамика антистрессорных реакций привела к значительному возрастанию К АС/С в 55 раз (р < 0,001) в основной группе больных относительно этого показателя в контрольной группе (рис. 3).
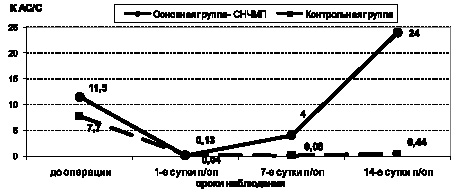
Рис. 3. Изменение соотношения адаптационных реакций у больных раком легкого на разных этапах лечения с применением СНЧ МП
При сопоставлении типов адаптационных реакций у больных раком легкого с осо-бенностями пространственной синхронизации корковых биопотенциалов (ПСКБ) было показано, что значения общего уровня синхронизации в обоих диапазонах ритмов бодр-ствования при различных антистрессорных АР тренировки, спокойной и повышенной активации достоверно превышали таковые при развитии реакции стресс. Наибольшие значения ПСКБ были отмечены у больных при спокойной и повышенной активации (табл. 1).
Анализ процессов синхронизации между отдельными корковыми зонами показал, что в альфа-диапазоне частот развитию антистрессорных АР соответствовали достоверно большие (по сравнению с реакцией стресс) значения ПСКБ. В лобно-затылочной паре отведений правого полушария эти значения соответствовали 0,36 ± 0,06 для стресса и 0,04 ± 0,10 – для повышенной активации (р < 0,05), а в цен-трально-затылочной паре этого же полушария – 0,20 ± 0,06 и 0,45 ± 0,07 соответственно (р < 0,05). Кроме того, было отмечено усиление межполушарного взаимодействия по показателю ПСКБ в центральной коре, которая является проекционной зоной неспецифического таламуса (0,69 ± 0,04 для стресса и 0,80 ± 0,03 для спокойной активации, р < 0,05) (рис. 4). Учитывая распространенное мнение о преимущественных связях правого полушария с неспецифическими структурами промежуточного мозга [3], мы пришли к выводу о непосредственном участии неспецифических таламических ядер в формировании антистрессорных адаптационных реакций спокойной и повышенной активации.
Таблица 1
Показатели общего уровня пространственной синхронизации в зависимости
от типа адаптационных реакций, у.е.
|
Ритмы ЭЭГ |
Стресс n = 26 |
Тренировка n = 36 |
Спокойная активация n = 16 |
Повышенная активация n = 6 |
Переактивация n = 6 |
|
Альфа-ритм |
6,26 ± 0,27 |
6,91 ± 0,32* |
7,51 ± 0,51* |
7,51 ± 0,33* |
7,34 ± 0,39 |
|
Бета-ритм |
6,13 ± 0,27 |
7,16 ± 0,27** |
7,83 ± 0,35** |
7,42 ± 0,52** |
6,75 ± 0,59 |
Примечание. * – Различия уровня ПСКБ в альфа-диапазоне частот с реакцией стресс достоверно значимы (р < 0,05); ** – различия уровня ПСКБ в бета-диапазоне частот с реакцией стресс достоверно значимы (р < 0,05).
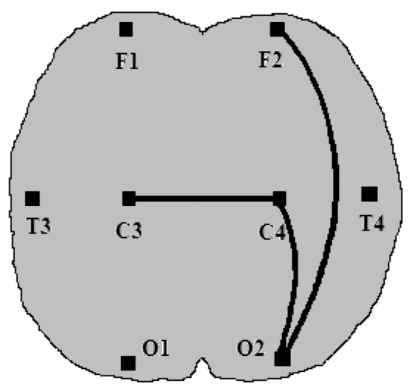
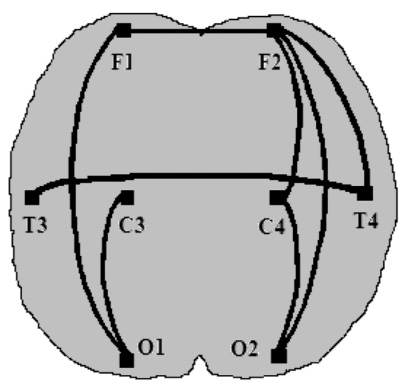
альфа-ритм бета-ритм
Рис. 4. Особенности пространственной синхронизации корковых биопотенциалов при реакциях спокойной и повышенной активации:
![]() – значение синхронизации достоверно выше, чем при реакции стресс (р < 0,05)
– значение синхронизации достоверно выше, чем при реакции стресс (р < 0,05)
В бета-диапазоне частот при формировании АР спокойной активации был отмечен достоверный относительно реакции стресс рост значений ПСКБ между симметричными зонами лобной и височной коры, а также в некоторых симметрично расположенных парах отведений правого и левого полушарий. Иначе говоря, наблюдалось усиление межполушарных, а также внутриполушарных симметрично регистрируемых взаимодействий (табл. 2).
Итак, на основании полученных данных можно было определить приоритетное значение использования ПО МТ в алгоритме лечения больных раком лёгкого над тради-ционным алгоритмом, включающим только хирургическое пособие. В доказательство этого мы попытались провести клинические параллели, связанные с уменьшением или отсутствием послеоперационных осложнений у больных основной и контрольной групп.
ПО МТ сопровождалась снижением общего числа осложнений с 34,3 % в контрольной группе до 19,9 % в основной (р < 0,05). Отличительной особенностью влияния ПО МТ явилось уменьшение осложнений, связанных с повышением свертываемости крови: не было отмечено ни одного случая тромбоэмболии легочной артерии, инфаркта миокарда, нарушения мозгового кровообращения. На фоне воздействия СНЧ МП уменьшилось число послеоперационных пневмоний и сердечно-сосудистых осложнений по сравнению с контрольной группой (1,6 и 2,6 %, 1,6 и 5,4 % соответственно). Важным фактом явилось также снижение послеоперационной летальности более чем в 2 раза по сравнению с контролем (3,2 и 7,3 % соответственно). Подводя итоги исследования, можно выделить ключевые моменты взаимодействия организма с внешним мультичастотным магнитным полем. Во-первых, воздействие СНЧМП с целенаправленным набором частот, близких к эндогенным ритмам мозга, способствуют сонастройке осцилляторной активности коры мозга, на что указывает увеличение на 25 % количества ЭЭГ с нормальным распределением альфа-ритма и возрастание в 2 раза мощности бета-активности нормальной амплитуды. Эти изменения сопровождаются достоверным повышением значений пространственной синхронизации при воздействии СНЧМП в ранний послеоперационный период над показателями контрольной группы: в альфа-диапазоне частот между центральной и височной зонами левого и правого полушарий, а в бета-диапазоне – между симметричными зонами височной и центральной коры. Во-вторых, регистрация уменьшения в 1,8 раза асимметрий значений электрокожного потенциала в 2-х парах контрольно-измерительных точек гипоталамуса свидетельствует об отклике основного механизма регуляции гомеостаза на действие фактора волновой природы с вариацией частотной составляющей. В итоге, триггерное влияние СНЧМП реализуется на уровне интегральных реакций организма путем перехода стрессовых состояний раннего послеоперационного периода у больных раком легкого в физиологические типы адаптационных реакций – тренировку и спокойную активацию. Наконец, важным доказательным моментом управляющего влияния мультичастотного воздействия СНЧМП служит установление прямой корреляционной связи между типами общих адаптационных реакций и значениями уровня пространственной синхронизации ритмов бодрствования, которые достоверно увеличиваются при развитии антистрессорных реакций по сравнению со стрессом. Биологический смысл таких изменений заключается в возможности инициации корково-подкоркового информационного взаимодействия и вовлечения каскадных механизмов нейро-гуморальной регуляции адаптивных процессов. Клинический смысл обусловлен свойственным антистрессорным реакциям повышением активной резистентности, как фундаментального условия снижения тяжелых послеоперационных осложнений и летальности, увеличения продолжительности и качества жизни, функциональной и социальной реабилитации больных раком легкого.
Таблица 2
Значения синхронизации (КК, бета-диапазон частот) в некоторых парах отведений, полученные при адаптационных реакциях стресс и спокойной активации
|
Адаптационные реакции |
Пары отведений |
|||||
|
F1О1 |
С3О1 |
F2О2 |
С4О2 |
F1F2 |
Т3Т4 |
|
|
Стресс |
0,02 ± 0,04 |
0,34 ± 0,04 |
–0,01 ± 0,04 |
0,29 ± 0,05 |
0,51 ± 0,04 |
0,21 ± 0,03 |
|
Сп. активация |
0,15 ± 0,09 |
0,50 ± 0,04 |
0,15 ± 0,04 |
0,44 ± 0,04 |
0,63 ± 0,05 |
0,33 ± 0,05 |
Примечание. Все значения КК, полученные для АР спокойной активации, достоверно превышают таковые при АР стресс (р < 0,05).

