Проблема лечения злокачественных опухолей актуализировала различные междисциплинарные подходы и продвижение технологий, включая биофизические взаимодействия на нано- и волновом уровнях в диапазонах лазерного, магнитного и ультразвукового излучений.
Исследовательское сообщество Defence Network DAPRA по проекту современных биотехнологий [8] сообщает об оригинальном методе использования наноразмерных частиц, обладающих магнитными свойствами. При проведении их точно в опухоль и наложении внешнего магнитного поля с сильным вращающим моментом инициируется термическая реакция наночастиц и достигается разогрев их тепловой энергией опухолевых клеток до несовместимой с жизнью температуры. Перспективность «магнитной гипертермии» несомненна, однако неопределенность дозирования вводимых частиц не может исключить влияния на формирование нежелательных аллергических состояний в связи с запуском иммунного ответа.
По данным Национального института здоровья США применение импульсного ультразвука высокой интенсивности также повышает температуру в ограниченных участках опухолевой ткани и вызывает их повреждение вплоть до распада [9]. При этом, воздействие ультразвука способствует улучшению проницаемости опухолевой ткани и снижению их устойчивости к лекарственным средствам. Это продемонстрировано на мышах после воздействия ультразвуком на раковые ткани, проницаемость которых возрастала в 9 раз. Биофизические эффекты повышения проницаемости мембран для вводимых лекарственных препаратов были получены при воздействии на очаг патологии не онкологической природы с помощью гелий-неонового лазера и импульсного переменного магнитного поля в сочетании с магнитофорной пластиной [2, 3]. Такой подход определяет как клинический смысл – улучшение лекарственного фореза за счет низкочастотной составляющей постоянного неоднородного полиградиентного поля, так и биологический смысл – осцилляторные взаимодействия экзогенных полей с собственной ритмикой биологических субстратов.
Учитывая постоянное неконтролируемое самовоспроизводство опухолевых клеток с мозаичной ритмикой деления, с позиций биофизики опухоль можно охарактеризовать как генератор собственных колебаний.
В трудах основоположников биофизики рака – Н.М. Эмануэля, Р.Е. Кавецкого, Б.Н. Тарусова, Е.П. Сидорик, Я.И. Ажипы, Г.М. Франка представлены убедительные данные о сигналах электронного парамагнитного резонанса – ЭПР – сигналы от различных видов опухолей у животных и человека, в том числе, саркомы 45, саркомы М-1, саркомы Иенса, карциномы Герена, лимфосаркомы Плисса, рака желудка и рабдомиосаркомы человека, а также других солидных и асцитных опухолей, источником которых являются парамагнитные центры и свободные радикалы. Н.М. Эмануэль показал, что некоторые парамагнитные центры, регистрируемые в перерождающихся тканях и в развивающихся опухолях, «отсутствуют» в нормальных тканях [6].
Как видно, опухоли обладают неупорядоченной осцилляторной активностью и индуцируют сильные частотные помехи в отношении ритмов нормальных тканей.
Альтернативой опухолевым осцилляциям и ее частотному хаосу может служить ограничение частотного разброса путем навязывания жесткого линейного режима сканирования с многократной периодичностью повторения фронта возмущения от минимума к максимуму. Эта идея может быть перспективной не только в отношении исключения демпфирования моночастотного сигнала, но в отношении нарушений частотного контура опухоли, структурно-функциональных пробоев на клеточном уровне: возможности изменения потока заряженных частиц через мембрану опухолевых клеток, высокой вариабельности мембранного потенциала, повышения проницаемости биомембран и, наконец, биодоступности клеточных барьеров к химиопрепаратам, а, следовательно, улучшения их доставки в опухоль.
Целью нашей работы явилось изучение возможности повышения биодоступности цисплатина в опухоль (модель саркомы 45) под влиянием сканирующего переменного и постоянного магнитных полей под контролем интенсивности флуоресценции опухолевых клеток.
Материал и методы исследования
Опыты проводились на 30 белых беспородных крысах-самцах с перевивной саркомой 45. Штамм клеток С-45 предоставлен институтом канцерогенеза ОНЦ им. Н.Н. Блохина РАМН. По достижению опухолью объема более 3,0 см3 проводили необходимые манипуляции в режиме острого эксперимента. После фиксации крысы в положении на животе и ее наркотизации парами эфира дезинфицировали кожу, делали надрез и открывали опухоль, сохраняя ее капсулу. Перитуморально проводили медленное подкапсульное введение 0,5 мл раствора цисплатина (ЦП) в концентрации 0,5 мг/мл и одновременно осуществляли воздействие на опухоль переменным магнитным полем в сканирующем режиме частот (СКМП) диапазона 1–150 Гц, индукцией 20 мТл в сочетании с постоянным магнитным полем (ПМП) 20 мТл в течение 10 минут. Эти условия создавались магнитотерапевтическим аппаратом «Градиент – 4М» [4]. После введения ЦП и воздействия СКМП оценивали флуоресцентные и цитометрические показатели клеток С-45 и инфильтрующих опухоль лейкоцитов. Клеточную взвесь С-45 окрашивали с помощью флуорохромов – АНС, ДСМ и доксорубицина [1].
Флуоресцентный зонд-катион ДСМ использовали в конечной концентрации 20 мкМ, АНС – 40 мкМ, ДР – 50 мкМ. Препараты живых клеток после 10–20-минутной инкубации с флуорохромами при температуре 22–25 °С исследовали под микроскопом «Axio Imager M2» Zeiss. Микросъемку производили цветной цифровой камерой AxioCam HRc, а измерения проводили с помощью программного обеспечения AxioVision, rel.4.8. Использовали модуль захвата изображения «MosaiX»: 6 колонок, 6 рядов, получая 36 кадров цифровых изображений, повторяя 3 раза на разных участках одного препарата. Измерения проводили интерактивно, измеряя в среднем от 100 до 400 клеток опухоли в каждой пробе и все попавшие при этом в поле зрения лейкоциты, в основном лимфоциты. Клетки опухоли измеряли одним инструментом – «Outline», а лейкоциты – другим: «Circle Out-In». Флуорохром ДСМ был синтезирован в НИИ физической и органической химии при ЮФУ. АНС был поставлен фирмой «Serva№. Длина волны возбуждения и ДСМ и ДР составляла 480 нм, а волны эмиссии – 520 нм. Для АНС эти параметры – 375 и 480 нм. При микросъемке строго соблюдали одинаковое разрешение и экспозицию для каждого флуорохрома в сравниваемых пробах. Данные измерений клеток сохраняли в приложении AxioVision, rel.4.8 в файле, совместимом с Excel (Microsoft Office-2003), которые затем сводили в общие электронные таблицы и статистически обрабатывали в Excel и программе Statistika 6.0. Массив показателей сортировали по инструменту измерения и, тем самым, отделяли показатели клеток опухоли от показателей лейкоцитов. Яркость клеток суммировали по трем каналам (RGB). Применяли как параметрические показатели (среднее и стандартное отклонение, t-test Стьюдента), так и непараметрические – критерий Вилкоксона для оценки различий (р-уровень).
Результаты исследования
и их обсуждение
Исследование прижизненных биоэлектрических свойств мембран опухолевых клеток по состоянию мембранного потенциала, оцениваемого методом потенциалозависимых флуоресцентных зондов, показало, что воздействие на опухоль СКМП увеличивает мембранный потенциал живых клеток в среднем на 80 % и гиперполяризует их. В таблице представлены результаты 15 серий измерения яркости флуоресценции АНС, ДСМ и ДР в относительных величинах соотношения показателей опухолевых клеток в каждой паре животных, получивших воздействие СКМП в сочетании с ПМП, к показателям клеток не получивших магнитного воздействия.
Показатели соотношения яркости флуоресценции АНС, ДСМ, ДР, связанных с клетками саркомы 45 при воздействии СКМП на опухоль in vivo и без воздействия.
Обозначение: Br = brightness (яркость)
|
Номер серии |
Численные значения отношения средних яркостей флуоресценции клеток опухоли при воздействии магнитного поля и без него (Br + МП) / (Br) |
||
|
(Br–АНС + МП) / (Br–АНС) |
(Br–ДСМ + МП) / (Br–ДСМ) |
(Br–ДР + МП) / (Br–ДР) |
|
|
1 |
0,33 |
1,24 |
1,63 |
|
2 |
0,37 |
0,83 |
1,81 |
|
3 |
0,96 |
1,22 |
1,76 |
|
4 |
0,63 |
0,91 |
1,52 |
|
5 |
0,51 |
5,70 |
1,84 |
|
6 |
1,36 |
0,83 |
1,66 |
|
7 |
1,40 |
1,33 |
1,41 |
|
8 |
1,82 |
1,24 |
1,99 |
|
9 |
1,65 |
1,60 |
1,76 |
|
10 |
0,96 |
2,80 |
2,28 |
|
11 |
0,92 |
12,31 |
1,92 |
|
12 |
1,12 |
10,40 |
1,83 |
|
13 |
0,97 |
3,70 |
2,18 |
|
14 |
1,03 |
3,21 |
2,43 |
|
15 |
1,05 |
3,52 |
1,93 |
|
М ± m |
1,00 ± 0,62* |
3,38 ± 3,7↑ |
1,96 ± 0,4*↑ |
Примечание: * – различия статистически значимы между отмеченными показателями, p < 0,05.
Судя по непосредственным результатам, можно видеть, что клетки опухоли, на которую локально in vivo было осуществлено воздействие СКМП и ПМП по сравнению с клетками опухоли без такого воздействия по-разному проявили способность к накоплению флуорохромов. Измерение яркости их флуоресценции показало, что только при воздействии СК МП наблюдалось статистически значимое увеличение проникновения цитостатика почти в 2 раза (p = 0,015, t–test). При этом, в одинаковых условиях воздействия накопление самих флуорохромов во всех 15 парах экспериментов происходило по-разному: в 8 случаях яркость АНС снижалась в клетках, которые подвергались воздействию поля, в 7 случаях – увеличивалась, так что в среднем показатели нивелировались. Другой флуорохром – катион ДСМ только в 3-х случаях показал снижение яркости свечения. В подавляющем большинстве замеров яркости свечения показатели демонстрировали значительное увеличение, особенно в двух парах (в 5 и 12 раз). В среднем накопление ДСМ увеличилось в клетках омагниченной опухоли почти в 4 раза.
На рисунке представлены поля зрения с клетками саркомы 45 с введением цисплатина без воздействия и с воздействием СКМП и ПМП. При всей этой разнообразной картине, можно безошибочно выделить главный отличительный признак клеточных ассоциатов С-45, подвергнутых воздействию СКМП и ПМП – значительное усиление яркости свечения, свидетельствующее о достоверном усилении проникновения в клетки опухоли препаратов, являющихся катионами, в отличие от аниона АНС.
Отмеченная нами ранее способность СКМП в сочетании с ПМП увеличивать мембранный потенциал живых клеток С-45 в среднем на 80 % и гиперполяризовать их относится к надпороговым эффектам, которые воспроизводились в 100 % проведенных опытов. Благодаря увеличению проницаемости мембраны для цитостатика, проявлялись морфологические признаки его повреждающего влияния, а именно, изменение размеров ядра, его разбухание, гиперхромность, а также усиление вакуолизации цитоплазмы. Данные о повышении биодоступности цисплатина внутрь клеток дополнялись рутинным биохимическим определением содержания цисплатины в ткани опухоли. Так, при введении под капсулу опухоли цисплатина суммарное количество препарата в слоях опухоли до 1 см определялось в количестве 8,0 мкг. При введении цитостатика с одновременным воздействием СКМП количество препарата на глубине до 1 см составляло 16,1 мкг, т.е. в 2 раза превышало контрольный уровень. При добавлении постоянной магнитной составляющей к воздействию СКМП содержание цисплатина достигло уровня 47,2 мкг, что практически в 6 раз повысило биодоступность химиопрепарата в ткань опухоли.
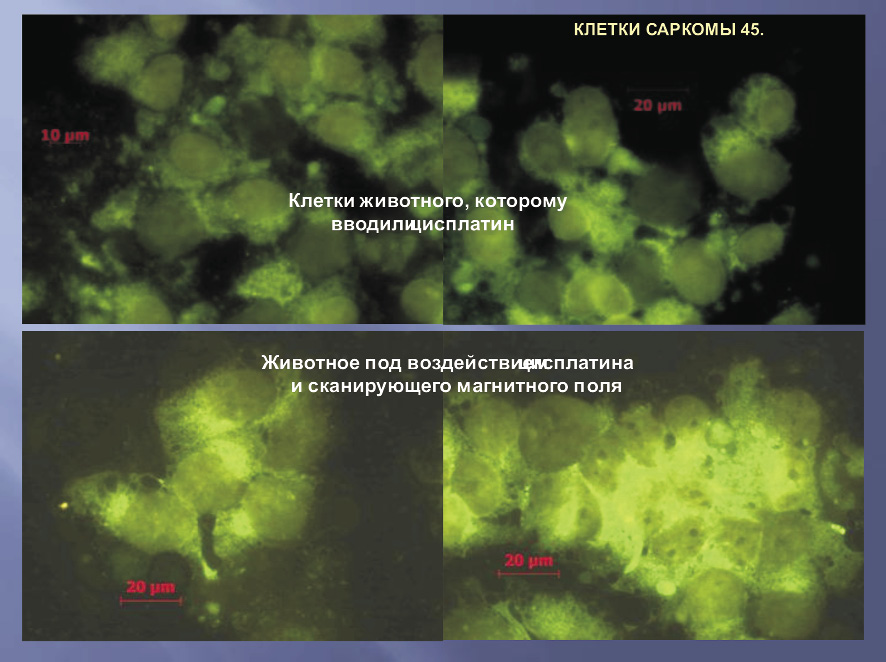
Различная яркость свечения клеточных ассоциатов саркомы 45 при воздействии цисплатина
со сканирующим магнитным полем и без него
В результате поглощения флуоресцентных зондов лимфоцитами, населяющими опухоль, можно сделать вывод о высокой неоднородности по яркости флуоресценции АНС, ДСМ и доксорубицина. Средняя яркость поглощенного АНС лимфоцитами, населяющими С-45, была в 1,5 раза меньше клеток саркомы и составляла 44 ± 15 у. е. Лимфоциты, связавшие ДСМ, имели среднюю яркость 21 ± 4 у. е., т.е. в 1,9 раз больше, чем клетки опухоли. Средняя яркость флуоресценции доксорубицина, накопленного в лимфоцитах, осталась прежней и составляла 17 ± 4 у. е. На основании полученных данных можно сделать заключение, что лимфоциты, населяющие саркому, гиперполяризованы более чем в 1,5 раза по отношению к опухолевым клеткам. Интересным является тот факт, что при этом соотношении мембранных потенциалов клеток саркомы и населяющих ее лимфоцитов плотность накопления доксорубицина теми и другими клетками остается одинаковой.
К механизму повышения проницаемости клеток С-45 имеют отношение особенности структурных формул потенциалочувствительных зондов АНС и ДСМ. Если зонд-анион АНС вследствие отрицательно заряженной внутренней стороны плазматической мембраны почти не проникает в цитоплазму и ядро, то зонд-катион ДСМ по той же причине и особенности липофильной части молекулы легко проникает в клетку. СКМП и ПМП, значительно гиперполяризуют мембрану опухолевой клетки, чем ускоряют погружение гидрофобной части молекулы ДСМ в липидный бислой плазматической мембраны и проникновение в клетку. Очевидно, подобным образом происходит воздействие и на проницаемость цисплатина внутрь клетки, где проявляется его способность образовывать прочные координационные специфические связи с ДНК [7]. Это связано с пространственным расположением азотсодержащих катионных групп с атомами водорода и Pt, позволяющих свободно проникать через гиперполяризованную магнитным полем мембрану и дальнейшему связыванию с двумя гуаниновыми основаниями ДНК.
Таким образом, молекулярный механизм явления повышения биодоступности в клетки опухоли химиопрепарата на примере цисплатина указывает на существенную роль клеточных мембран и их взаимодействию с низкомолекулярными субстратами. Снижение конформационной подвижности макромолекул в результате адсорбции, по мнению Л.Х. Эйдус [5], означает неспособность клетки противостоять воздействию. Зависимость «пропускной» способности мембран опухолевых клеток от модифицирующего влияния данного вида магнитного поля может играть важную роль в повышении эффективности химиотерапии при локальном лечении рака полостных органов.

