В настоящее время морская среда, в результате антропогенного загрязнения, часто является источником бактерий патогенных и потенциально-патогенных для человека и животных. В прибрежной воде, особенно в местах сброса сточных вод, могут быть обнаружены разнообразные патогенные микроорганизмы (холерные вибрионы, легионеллы, сальмонеллы, стафилококки, псевдомонады, иерсинии, листерии и др.), которые обитают и длительно сохраняются в естественных условиях водоемов (4).
Многосторонне изучено воздействие абиотических факторов на существование и популяционную динамику ряда патогенных бактерий – псевдотуберкулезного микроба, кишечных иерсиний, листерий и др. [1].
Изучение биотических факторов, способствующих длительному сохранению патогенных бактерий в водных экосистемах, началось сравнительно недавно. Актуальным является изучение факторов выживания популяций патогенных бактерий в водной морской среде и путей их циркуляции, связанных с гидробионтами. Симбиотическое взаимодействие патогенных микроорганизмов с различными сообществами водных биот: простейшими, моллюсками, червями, рыбами и другими гидробионтами позволяет им выживать в морской среде [4].
Другим фактором выживания патогенных бактерий в водной среде является их способность к симбиотическим взаимоотношениям с одноклеточными водорослями. Экспериментальными исследованиями показано, что адгезия и колонизация клеток сальмонелл к поверхностям микроводорослей, а также сохранность клеток хлорелл, указывают на их симбиотические взаимоотношения и возможность накопления популяций сальмонелл в водной среде в летний период [5]. Микроводоросли выделяют в морскую среду различные метаболиты. Максимальные величины внеклеточных выделений микроводорослей характерны для летнего периода, минимальные – для зимнего. Разнообразен химический состав экзометаболитов микроводорослей – это углеводы, аминокислоты, органические кислоты, липиды и их производные, фитогормоны, фенолы, изопреноиды, витамины, токсины и др. [7]. Они оказывают стимулирующее, ингибирующее и другие влияния на сопутствующую микрофлору. В настоящее время ведется интенсивное изучение процессов выделения экзометаболитов водорослями как в природных популяциях, так и в лабораторных культурах, однако многие вопросы не ясны. Большой интерес представляет биологическая активность внеклеточных веществ, экскретируемых водорослями в окружающую среду, особенно ростстимулирующая активность, позволяющая патогенным бактериям выживать и размножаться в морских экосистемах.
В ранее опубликованных нами исследованиях было установлено, что экзометаболиты стационарной фазы роста микроводорослей стимулируют размножение патогенных бактерий [1, 2]. Показано также, что только экзометаболиты этилацетатного экстракта культуральной среды микроводоросли P. tricornutum, культивируемой в естественной морской воде, взятой в летний сезон, обладают ярко выраженным стимулирующим действием на рост всех взятых в эксперимент тест-микроорганизмов [2].
Цель исследования. Целью настоящего исследования является изучение влияния фракций этилацетатного экстракта экзометаболитов морской микроводоросли P. tricornutum на размножение патогенных бактерий – Staphilococcus aureus и Salmonella tiphimurium.
Материалы и методы исследования
Исследование проводили с альгологически чистой культурой морской микроводоросли Phaeodactylum tricornutum Bohlin, полученной из коллекции Института биологии моря им. A.B.Жирмунского ДВО РАН (г. Владивосток). В качестве тест-культур использовали штаммы Staphylococcus aureus и Salmonella typhimurium, типичные по своим культурально-морфологическим, биохимическим и антигенным свойствам.
Р. tricornutum культивировали в модифицированной среде Гольдберга [6], содержащей природную морскую воду соленостью 32 %, взятую в начале июля в б. Лазурная Уссурийского залива. Водоросль выращивали в 750 мл колбах с 250 мл среды при 200 °С с использованием свето-темнового режима – 12 ч: 12 ч при освещении люминесцентными лампами 3500 лк в течение 14 суток до стационарной стадии роста культуры. Исходная концентрация клеток составляла 2-5х104 кл/мл, в конце опыта – 1100-1300х104 кл/мл.
Kлетки микроводоросли отделяли от культуральной жидкости (КЖ) центрифугированием при 6000 об/мин. КЖ фильтровали через бактериальный фильтр с диаметром пор 0,22 мкм. Экзометаболиты (ЭМ) микроводоросли Р. tricornutum получали экстракцией этилацетатом культуральной жидкости, взятой в стационарной фазе роста. Таким образом были получены: вещества этилацетатного экстракта (ЭАЭ) КЖ. Вещества ЭАЭ КЖ дополнительно разделяли на колонке с силикагелем (40-63 мкм), используя растворители (гексан, этилацетат-метанол, метанол), получили 4 фракции. Исследовали биологическое действие всех фракций экзометаболитов микроводоросли на рост Staphylococcus aureus и Salmonella typhimurium. Контролем служили аналогичные фракции органических веществ, полученные колоночной хроматографией ЭАЭ природной морской воды.
Изучение динамики роста штаммов Staphylococcus aureus и Salmonella typhimurium в среде Патерсона-Кука (pH7,2 – 7,4) с 0,1 % глюкозой и экзометаболитами (40 мкг/мл) проводили при периодическом культивировании в течение 14 суток при температуре 200С. Численность бактерий определяли спектрофотометрически по оптической плотности (ОП) культуральной среды при λ= 600 нм на спектрофотометре СФ-46 (ЛОМО, Россия) и T70 UV/VIS Spectrometer PG Instruments Ltd (Англия). Биологическую активность экзометаболитов микроводоросли Р. tricornutum определяли по изменению роста штаммов Staphylococcus aureus и Salmonella typhimurium, выраженному в процентах по отношению к контролю: ОПо600/ОПк600х100 % – 100 %. Контроль принимался за 100 %.
Результаты исследования и их обсуждение
Данные, полученные в результате исследования биологической активности этилацетатного экстракта КЖ P. tricornutum представлены в табл. 1
Таблица 1
Биологическое действие экзометаболитов ЭАЭ КЖ микроводоросли P. tricornutum на рост S. aureus и S. typhimurium в % от контроля ( контроль взят за 100 %)
|
Продолжительность опыта, сутки |
1 |
2 |
3 |
6 |
7 |
8 |
9 |
10 |
13 |
14 |
|
Биологическое действие ЭАЭ КЖ на рост S.aureus, % |
+33,9 ± 0,2 |
+50,0 ± 0,3 |
+36,9 ± 0,2 |
+55,6 ± 0,3 |
+14,5 ± 0,1 |
+34,1 ± 0,2 |
+37,0 ± 0,2 |
+25,3 ± 0,1 |
+25,3 ± 0,1 |
+31,1 ± 0,2 |
|
Биологическое действие ЭАЭ КЖ на рост S.typhimurium, % |
+8,6 ± 0,02 |
+17,0 ± 0,1 |
+22,6 ± 0,1 |
+24,5 ± 0,1 |
+19,3 ± 0,1 |
+22,1 ± 0,1 |
+17,6 ± 0,1 |
+28,2 ± 0,2 |
+36,6 ± 0,2 |
+27,1 ± 0,2 |
Согласно данным табл. 1, экзометаболиты ЭАЭ КЖ P. tricornutum стимулировали рост стафилококков и сальмонелл на протяжении 14 суток наблюдений, однако больший эффект наблюдался для S.aureus – уже на 2 сутки рост увеличился на 50 %.
Разделение ЭАЭ КЖ P. tricornutum на отдельные фракции методом колоночной хроматографии на силикагеле дало 4 фракции веществ в порядке возрастания их полярности. Динамика роста Staphylococcus aureus и Salmonella typhimurium в среде Патерсона-Кука с 0,1 % глюкозой и ЭМ фр.1 контроля и опыта при температуре 20 °С представлена на рис. 1 и рис. 2.
Биологическое действие фракций представлено в табл. 2 и 3.
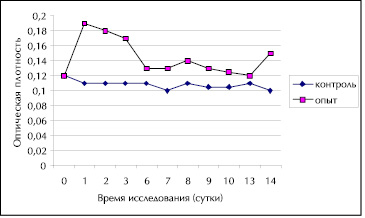
Рис. 1. Динамика роста Staphylococcus aureus в среде Патерсона-Кука с 0,1 % глюкозой и ЭМ фр.1 контроля и опыта при температуре 20 °С
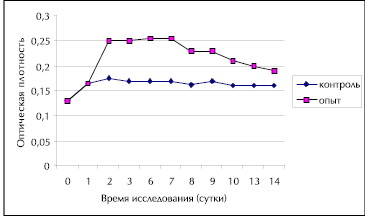
Рис. 2. Динамика роста Salmonella typhimurium в среде Паттерсона-Кука с 0,1 % глюкозой и ЭМ фр.1 контроля и опыта при температуре 20 °С.
Таблица 2
Биологическое действие фракций экзометаболитов ЭАЭ КЖ микроводоросли P.tricornutum на рост Staphylococcus aureus в % от контроля ( контроль взят за 100 %)
|
Фракции |
1с |
2с |
3с |
6с |
7с |
8с |
9с |
10с |
13с |
14с |
|
Фр.1 |
+72,7 ± 0,3 |
+63,6 ± 0,3 |
+54,5 ± 0,3 |
+18,2 ± 0,1 |
+30,0 ± 0,2 |
+27,3 ± 0,2 |
+23,8 ± 0,2 |
+19,0 ± 0,1 |
+9,1 ± 0,03 |
+50,0 ± 0,3 |
|
Фр.2 |
0,0 ± 0,0 |
-7,1 ± 0,01 |
-13,0 ± 0,1 |
-39,3 ± 0,2 |
-51,9 ± 0,3 |
-56,8 ± 0,3 |
-74,6 ± 0,3 |
-75,6 ± 0,3 |
-77,3 ± 0,3 |
-63,0 ± 0,3 |
|
Фр.3 |
0,0 ± 0,0 |
+18,1 ± 0,1 |
+10,0 ± 0,03 |
-16,7 ± 0,1 |
-8,3 ± 0,03 |
-8,3 ± 0,03 |
-4,2 ± 0,02 |
-4,5 ± 0,02 |
-4,8 ± 0,02 |
-5,0 ± 0,02 |
|
Фр.4 |
0,0 ± 0,0 |
0,0 ± 0,0 |
-9,2 ± 0,03 |
-15,2 ± 0,1 |
-13,0 ± 0,1 |
+8,0 ± 0,03 |
+10,0 ± 0,1 |
+10,0 ± 0,1 |
+1,6 ± 0,01 |
0,0 ± 0,0 |
Таблица 3
Биологическое действие фракций экзометаболитов ЭАЭ КЖ микроводоросли P.tricornutum на рост Salmonella typhimurium в % от контроля ( контроль взят за 100 %)
|
Фракции |
1с |
2с |
3с |
6с |
7с |
8с |
9с |
10с |
13с |
14с |
|
Фр.1 |
0,0 ± 0,0 |
+47,1 ± 0,3 |
+47,1 ± 0,3 |
+47,1 ± 0,3 |
+50,0 ± 0,3 |
+42,0 ± 0,2 |
+35,3 ± 0,2 |
+27,3 ± 0,2 |
+25,0 ± 0,1 |
+18,8 ± 0,1 |
|
Фр.2 |
+2,6 ± 0,02 |
+2,5 ± 0,02 |
+6,4 ± 0,03 |
+2,6 ± 0,02 |
+1,1 ± 0,01 |
+4,3 ± 0,02 |
+9,8 ± 0,03 |
+9,1 ± 0,03 |
+5,3 ± 0,03 |
+17,4 ± 0,1 |
|
Фр.3 |
-2,3 ± 0,02 |
-3,6 ± 0,02 |
0,0 ± 0,0 |
0,0 ± 0,0 |
+4,7 ± 0,03 |
+9,1 ± 0,03 |
+10,3 ± 0,1 |
+11,1 ± 0,1 |
+8,0 ± 0,03 |
-1,5 ± 0,01 |
|
Фр.4 |
0,0 ± 0,0 |
+2,3 ± 0,01 |
+4,7 ± 0,03 |
0,0 ± 0,0 |
-3,6 ± 0,02 |
-1,8 ± 0,01 |
-3,2 ± 0,02 |
-1,5 ± 0,01 |
-2,4 ± 0,01 |
+2,7 |
Как видно из данных, представленных на рис. 1, 2 и в табл. 2, 3 вещества фр.1 стимулировали рост стафилококков и сальмонелл на протяжении 14 суток наблюдений с максимальным эффектом 72,7 % на 1 сутки для стафилококка (рис. 1, табл. 2) и 47,1-50,0 % на 2-7 сутки для сальмонеллы (рис.2, табл.3). Сравнение результатов по биологическому действию ЭАЭ КЖ и фр.1 (табл. 1, 2, 3) показало, что ростстимулируюший эффект фр.1 в 2 раза выше для Staphylococcus aureus уже на 1 сутки культивирования и в 2,8 раза для Salmonella typhimurium на 2 сутки.
По данным литературы, стимулирующее действие экзометаболитов на размножение сопутсвующей микрофлоры объясняется влиянием метаболических органических веществ микроводоросли, являющихся доступным питательным субстратом для бактерий [9]. Другие авторы объясняют стимулирующее действие экзометаболитов зеленых водорослей присутствием фитогормонов, которые выделяются в среду [10].
Фр. 2 обладала уже ингибирующим действием на рост Staphylococcus aureus (максимальный эффект 77,3 % на 13 сутки), а на рост Salmonella typhimurium фр.2 продолжала оказывать слабое стимулирующее действие. Биологическое действие фр.3 и фр.4 было незначительным как для стафилококка, так и для сальмонеллы.
Из литературы также известно, что близкое расположение фракций стимуляторов и ингибиторов свидетельствует о сходстве их строения, однако, вещества сходного строения могут проявлять разную биологическую активность,их биологическое действие зависит от концентрации и соотношения этих веществ [3].
Заключение. Таким образом, мы выяснили, что экзометаболиты морской микроводоросли P. tricornutum, культивируемые в естественной морской воде летнего сезона содержат вещества, обладающие ростстимулирующим и ростингибирующим действием на патогенные бактерии – Staphylococcus aureus и Salmonella typhimurium, причем ростстимулирующая активность экзометаболитов микроводоросли преобладает, что дает возможность бактериям размножаться в морской среде.
Экстракцией этилацетатом КЖ P. tricornutum получили стимуляторы роста патогенных бактерий. Сочетанием методов экстракции КЖ микроводоросли этилацетатом и разделения активных веществ колоночной хроматографией можно добиться выделения максимально активной фракции экзометаболитов P. tricornutum, стимулирующей рост стафилококков и сальмонелл эффективнее в 2-3 раза.
Методика получения биологически активных веществ, стимулирующих рост Staphylococcus aureus и Salmonella typhimurium может быть использована для приготовления диагностикума с целью выявления патогенных бактерий из морской среды.

