Выживание патогенных бактерий, занимающих различные экологические ниши, может быть основано на симбиотическом взаимоотношении с различными биологическими объектами. Подобное взаимодействие патогенных микроорганизмов с представителями биоценоза различных естественных экосистем позволяет им сохраняться в сапрофитическом состоянии в межэпидемические периоды [4].
Одной из экологических ниш для патогенных бактерий является почва, имеющая свою биоту, составной частью которой является множество микроорганизмов с разнообразными биологическими свойствами. Жизнедеятельность микроорганизмов в почве осуществляется в основном на почвенных частицах, в определенных микрозонах которых представлены клетки, питательные вещества и микробные метаболиты.
Многие исследователи [1, 2] считают, что соединения, продуцируемые микроорганизмами, могут действовать как внутри- или межвидовые регуляторы микробных сообществ. Помимо веществ растворимых в воде, среди метаболитов, продуцируемых микроорганизмами, есть и летучие вещества [12]. При этом отмечено как стимулирующее, так и ингибирующее действие веществ микробного происхождения на размножение микроорганизмов [7, 12]. Изучение характера взаимоотношений между бактериями в микробоценозах имеет большое значение для выяснения роли отдельных компонентов в биологических сообществах.
Возможность того, что естественная микрофлора почвы может оказывать положительное влияние на сохранение патогенных микроорганизмов, представляет особый интерес для исследований в этом направлении. В отношении влияния почвенной микрофлоры на биологические свойства патогенов, входящих в состав микробного сообщества, имеются единичные работы [5, 7, 9].
Возбудитель листериоза, как представитель сапрозоонозной инфекции, длительно сохраняется и размножается в почвенных экосистемах [3, 11].
В настоящее время установлено, что на жизнеобитание этих бактерий в почвах оказывают влияние как абиотические факторы среды [6, 10], так и биотические [7, 8]. Влияние метаболитов сапрофитных почвенных бактерий, ассоциированных с листериями в почвенных сообществах, на размножение Listeria monocytogenes практически не изучено.
Цель исследования. Цель настоящей работы – изучить влияние летучих метаболитов сапрофитных бактерий, выделенных из микробоценозов разных типов почв, на размножение Listeria monocytogenes.
Материалы и методы исследования
При проведении экспериментальных исследований в качестве объектов исследования были использованы штаммы сапрофитных бактерий, выделенные из разных типов почв: бурая лесная типичная, бурая лесная оглеенная, дерново-подзолистая, буро-подзолистая. Почвенные образцы отбирали из верхнего (0-10 см) горизонта.
Для каждого типа почвы были определены указанные показатели (табл. 1).
Таблица 1
Физико-химические свойства почвенных образцов
|
Показатели тип почвы |
рН |
Гумин, % |
С, % |
|
бурая лесная типичная |
6,5 |
17,39 |
2,0 |
|
дерново-подзолистая |
5,4 |
30,5 |
2,5 |
|
буро-подзолистая |
7,3 |
22,14 |
2,6 |
|
бурая лесная оглеенная |
5,5 |
10,4 |
1,1 |
Выбор представленных биотопов объясняется тем, что наибольшее количество выделений L. monocytogenes отмечается в почвах лесной зоны (Гершун, 1988; Сомов, Литвин, 1988). Данные биотопы представляют высокий риск в распространении листериозной инфекции.
В качестве тест-микроорганизмов для исследования были использованы штаммы Listeria monocytogenes, типичные по своим культуральным, серологическим и биохимическим свойствам, взятые из музея «НИИЭМ имени Г.П. Сомова» СО РАМН.
Сапрофитные бактерии выделяли и выращивали для экспериментов на пептонном агаре (ПА) (1 % пептона, 0,5 % NaCI на дистиллированной воде с 2 %-м агаром, рН=7,4) при температуре 22 °С, 20-24 ч. Листерии культивировали на питательном агаре с дрожжевым экстрактом и 0,1 % глюкозой при температуре 37 °С, 20-24 ч.
Морфотипы сапрофитных бактерий выделяли по морфологическим и культуральным признакам колоний. Микроскопию, окрашенных по Граму мазков, проводили на микроскопе Axio Scope A1 («Carl Zeiss», Германия).
Для определения биологической активности летучих метаболитов использовали скрининговый экспресс-метод Л.С. Тирранен (1980) в нашей модификации. Культуру сапрофитных бактерий высевали газоном на чашки Петри с питательным агаром. На чашки Петри с казеиново-дрожжевым агаром производили посев уколом культуры листерий. Чашки с посевами сапрофитов и листерий соответственно состыковывали. Посевы выдерживали в течение семи суток при комнатной температуре.
Для оценки размножения L. monocytogenes замеряли зоны роста в месте укола. Воздействие культуры сапрофитов на тест-культуру L. monocytogenes оценивали как положительное (стимулирующее) или отрицательное (ингибирующее), когда размер колоний тест-культур в опыте был соответственно увеличен или снижен на 20 % и более по сравнению с контролем. Если размер колоний тест-культуры L. monocytogenes в опыте отличался от контрольной не более чем на ±20 %, действие испытуемой культуры оценивали как нулевое. Долю случаев положительного влияния летучих метаболитов на листерии выражали в процентах (%). Критерием отбора активных штаммов, проявивших максимальную стимуляцию размножения листерий, служил диаметр зон роста листерий больше 10 мм (d ≥ 10).
Все опыты проводились в трехкратной повторности. Статистическую обработку результатов проводили с помощью программы Microsoft Office Excel 2007.
Результаты исследования и их обсуждение
Всего было выделено 135 морфотипов сапрофитных бактерий, различных по своим культуральным и морфологическим признакам (табл. 2).
Таблица 2
Биологическая активность и численность морфотипов сапрофитных бактерий, выделенных из разных типов почв
|
Источник выделения |
Общее количество штаммов |
Доля случаев положительного влияния на рост листерий, % |
Количество активных штаммов |
Количество штаммов, активных в отношении L. monocytogenes, серотип 4b |
|
бурая лесная типичная |
53 |
76,5 |
7 |
1 |
|
дерново-подзолистая |
23 |
48,3 |
6 |
2 |
|
буро-подзолистая |
35 |
55,7 |
10 |
3 |
|
бурая лесная оглеенная |
24 |
32,5 |
5 |
3 |
Высокие показатели численности морфотипов (табл. 2), выделенных из бурой лесной типичной и буро-подзолистой объясняются тем, что для данных типов почв характерен богатый растительный опад, преимущественно широколиственных пород, слабокислая реакция среды, высокая насыщенность основаниями и достаточное количество легкоокисляемой органики, что способствуют интенсивному развитию в них микроорганизмов и многообразию видов.
Меньшая численность морфотипов (в 2 раза меньше по сравнению с бурой лесной типичной), выделенных из дерново-подзолистой почвы объясняется малой мощностью дернового горизонта и кислой реакцией (рН=5,4), которая неблагоприятна для многих микроорганизмов.
Численность морфотипов, выделенных из бурой лесной оглеенной почвы, также низка, по сравнению с бурой лесной типичной. Это объясняется типичным для бурой лесной оглеенной почвы рядом характеристик. Процессы оглеения, происходящие в бурой лесной оглеенной почве, связаны с избыточным переувлажнением, развитием восстановительных процессов в анаэробных условиях, подкислением реакции почвы, что неблагоприятно отражается на качественной и количественной структуре микрофлоры эти почв.
Если рассматривать показатели биологической активности выделенных штаммов на тест-культуры, то видно, что сапрофитная микрофлора бурых лесных типичных почв оказывает наибольшее стимулирующее влияние на листерии, по сравнению с сапрофитными бактериями, выделенными из остальных типов почв (буро-подзолистая, дерново-подзолистая, бурая лесная оглеенная) (рисунок 1, а). При этом наибольшее количество активных штаммов выделено из буро-подзолистой почвы (табл. 2).
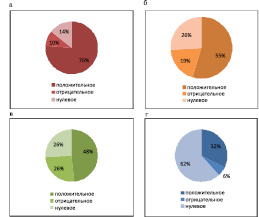
Оценка влияния летучих метаболитов сапрофитных бактерий, выделенных из разных типов почв, на размножение листерий, ( % случаев): а – бурая лесная типичная, б – буро-подзолистая, в – дерново-подзолистая, г – бурая лесная оглеенная
Штаммы, выделенные из бурой лесной оглеенной почвы оказывали стимулирующее влияние в 32 % случаев (рис. 1, г). На диаграмме показано, что большинство случаев характеризовались как нулевые, они могли быть слабо отрицательными или слабо положительными. Но, несмотря на меньшее число морфотипов и количество активных штаммов из бурой лесной оглееенной почвы, они в большей степени проявили биологическую активность в отношении эпидемически значимого штамма L. monocytogenes, серотип 4b (табл. 2).
Результаты сравнительной характеристики показывают зависимость количества морфотипов бактерий и их биологической активности от источника выделения (типы почв). Выявлено, что показатели биологической активности выше у штаммов, выделенных из почв с неблагоприятными для микроорганизмов условиями.
Выводы
Таким образом, отмечено стимулирующее, ингибирующее и нулевое действие летучих метаболитов сапрофитных почвенных бактерий. Количественная оценка влияния летучих метаболитов на размножение листерий, показала, что в большинстве случаев преобладает положительное действие. Так же выявлено, что численность морфотипов бактерий, а также их биологическая активность в отношении листерий зависела от условий типа почв из которых они выделены. Большую степень биологической активности проявили штаммы из почв с неблагоприятными для микроорганизмов условиями.

