Сегодня в мире активно обсуждаются вопросы клеточной медицины и биотехнологии. Современная медицина рассматривает методики лечения с использованием плюрипотентных аутоклеток пациента при различных патологиях как одни из самых перспективных [5, 7]. Наряду с гемопоэтическими клетками, перспективно использование мультипотентных мезенхимальных стромальных клеток костного мозга. Мультипотентные мезенхимальные стромальные клетки костного мозга были обнаружены среди адгезивной фракции клеток стромы костного мозга [2, 5]. В экспериментах in vitro была показана высокая пролиферативная активность этих клеток, а также их способность дифференцироваться в жировую, костную, хрящевую, нейрональную и мышечную ткань [1, 3]. В отдельных экспериментах удавалось дифференцировать эти клетки в кардиомиоциты, гепатоциты, инсулин-продуцирующие клетки [2, 8].
В настоящее время в клинических испытаниях преимущественно используются аутологичные мультипотентные мезенхимальные стромальные клетки аспирата костного мозга. Процедура получения материала достаточно болезненна и травматична и может вызвать ряд нежелательных реакций [4, 6]. В изученной литературе мы не нашли однозначного ответа на вопрос, какую методику получения прогениторных клеток безопаснее и лучше использовать. В то же время ясно, что это должен быть аутологичный материал, методы получения клеток максимально безопасными и насколько это возможно, минимально инвазивными.
Цель исследования. Оценить безопасность и эффективность выделения из периферической крови мобилизированных клеток костного мозга с использованием процедуры цитафереза на сепараторе клеток Haemonetics, MCS+.
Материалы и методы исследования
В исследование входило 33 пациента с различной терапевтической патологией, в рамках протоколов одобренных локальным этическим комитетом НИИКЭЛ СО РАМН, протоколы №35 от 29.08.2007 «Хирургические и клеточные методики лечения больных с облитерирующим атеросклерозом», протокол № 7 от 10.10.2007 “Изучение эффективности лечения больных с постмастэктомической лимфедемой с применением мобилизированных под действием нейпогена малых лимфоцитов». Введение пациентам препарата Нейпоген(G-CSF) п/к в течение 5 дней в дозе 10мкг/кг веса для увеличения пула прогениторных клеток в периферической крови путем их мобилизации из костного мозга. Проводится ежедневный скрининг количества лейкоцитов, тромбоцитов, свертываемости периферической крови ежедневно. На 6 сутки с целью сбора периферических прогениторных клеток использовали аппаратный цитаферез на сепараторе клеток крови «Haemonetics», MCS+, протокол PBSC, сет REF 971 E (Haemonetics Corporation, США).
Методика проведения процедуры аппаратного цитафереза. После катетеризации периферической вены пациенту внутривенно капельно переливали 250 мл раствора кристаллоидов (0,9 процентный раствор NaCl + гепарин 100 ед/кг). Скорость перфузии составляла от 30 мл/мин до 50 мл/мин, объем перфузируемой крови за процедуру зависел от концентрации получаемых лимфоцитов и составлял от 30 до 40 % объема циркулирующей крови. Скорость центрифуги, количество используемого антикоагулянта определялись автоматически, в рамках протокола PBSC. Во время процедуры цитафереза осуществлялся мониторинг артериального давления, пульса, сатурации («NIHON KOHDEN», Japan). Полученная взвесь клеток в дальнейшем отстаивалась при температуре 37 гр.Цельсия во флаконе в течение 1-1,5 ч. Сбор прогениторных клеток из флакона и осаждение клеток 8-10 мин в центрифуге при 1.5тыс об/мин. Работа проводится в стерильных условиях с использованием ламинарных боксов (II класс микробиологической безопасности) с использованием стерильной (гамма-облучение) одноразовой посуды. Отмывка и сбор клеточной суспензии. Выделение фракции прогениторных клеток осуществлялось на градиенте плотности фиколла-верографина. Оценивалась структурная целостность клеток. С этой целью выделенную из крови взвесь клеток фиксировали в 2,5 % растворе глютаральдегида на фосфатном буфере, затем в 1 % растворе ОsО4 на фосфатном буфере, дегидратировали в этиловом спирте возрастающей концентрации и заключали в эпон. Из полученных блоков готовили полутонкие срезы толщиной 1 мкм, окрашивали толуидиновым голубым, изучали под световым микроскопом и выбирали необходимые участки для исследования в электронном микроскопе. Из отобранного материала получали ультратонкие срезы толщиной 35-45 нм на ультратоме LKB-8800, контрастировали насыщенным водным раствором уранилацетата, цитратом свинца и изучали в электронном микроскопе JEМ 1010. Лимфоциты фотографировали при увеличении 6000 в электронном микроскопе. Морфометрические исследования лимфоцитов выполняли в соответствии с общепринятыми принципами и методами при увеличении в 48000 и использовании открытой тестовой системы. Статистическую обработку количественных показателей проводили с помощью критерия Стьюдента, достоверность различия считали при Р≤0,05. В полученной взвеси клеток 63+17*106/мл, p<0.05., определяли содержание цитокинов мононуклеарных клеток. Содержание в супернатантах цитокинов оценивали методом ИФА (Вектор-Бест).
Результаты исследования и их обсуждение
Процедуры, связанные с протоколом исследования, переносились хорошо, не зарегистрировано осложнений, как во время мобилизации клеток из костного мозга, так и во время процедуры цитафереза. Переносимость процедуры пациентами оценивалась, как удовлетворительная. Исследование показало, что момнонуклеары, полученные на сепараторе клеток крови Haemonetics MCS+, сохраняли структурную целостность (рис. 1).
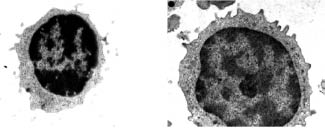
Рис. 1. Ультраструктура выделенных из крови мононуклеаров
В цитоплазме клеток отмечали немногочисленные цистерны гранулярного эндоплазматического ретикулума, комплекса Гольджи, прикрепленные и свободные полисомальные рибосомы, лизосомы. Немногочисленные митохондрии имели хорошо выраженные кристы. Ядро имело обычное для мононклеаров распределение гетерохроматина. Плазматическая мембрана клеток образовывала выросты и микроворсинки (рис. 2).
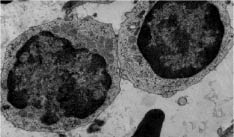
Рис. 2. Ультраструктура выделенных из крови лимфоцитов. Увеличение 12000
Количество гемопоэтических и эндотелиальных прогениторных стволовых клеток полученных на сепараторе клеток крови составило:
– CD 34+: 45,0+3,1·10,6/мл.
– CD34+/133+: 1,0+0,10·10,6/мл.
– CD34+/VEGFR2: 2,0+0,14·10,6/мл.
Заключение
Таким образом, методика выделения мононуклеаров на сепараторе клеток крови Haemonetics, МСS+ не приводят к нарушению структуры клеток, не вызывает повреждения мононуклеарных клеток. Является малоинвазивной и безопасной методикой для пациента, что немаловажно в клиническом аспекте. Учитывая количество клеток с фенотипом гемопоэтических и эндотелиальных прогениторных клеток, мононуклераные клетки мобилизованные и полученные предложенным нами способом, могут служить источником стволовых клеток для стимуляции ангиогенеза и лимфангиогенеза.

