Одной из острейших проблем современности является антропогенное воздействие на гидросферу. Тяжелые металлы рассматриваются, как приоритетные химические поллютанты, представляющие особую опасность для организмов и биоценозов, вследствие того, что многие из них обладают биологической активностью, способны аккумулироваться в тканях различных организмов, не подвергаются биодеградации и крайне медленно покидают биологический цикл [2, 5].В качестве ведущих механизмов нарушения клеточного метаболизма при экспонировании биообъектов тяжелыми металлами выделяют ферментотоксическое, мембранотропное действие и оксидативный стресс [11].
К числу наиболее опасных тяжелых металлов относится кадмий. Точный механизм токсического действия кадмия неизвестен, хотя он, безусловно, многоступенчатый [8].Катионы кадмия могут нарушать структурную целостность мембран, приводящую к их деформациям, лизису клетки и её гибели. Под их воздействием разрушаются мембраны эритроцитов, и развивается гемолиз [9], связываясь с аминогруппами белков, вызывают угнетение активности ферментов [7, 13].Кадмий обладает местно-раздражающим и резорбтивным действием. При остром отравлении хлористым кадмием обнаруживают гиперплазию и распад респираторного эпителия жабр [11, 14], эпидермиса кожи, некробиоз кишечника и проксимальных канальцев почек, гемопоэтической ткани. Хроническая интоксикация выражается замедлением роста, некробиотическими изменениями в жабрах, почках [12], печени, гемопоэтической ткани, угнетением клеточных факторов иммунитета крови в виде лейкопении [6]. Воздействие соединений кадмия вызывает весь спектр генетических изменений в организме: геномные, генные мутации и хромосомные аберрации. Так, например, хлорид кадмия способен индуцировать такие повреждения хромосом, как нарушение конденсации, фрагментация, слипание и отставание хромосом, хромосомные мосты, мультиполярные анафазы и др. [1].
Важную роль в метаболизме, росте и развитии, а также адаптации гидробионтов к различным видам токсикологической нагрузки играют белки, липиды и углеводы. В связи с этим очевидна значимость определения качественных изменений белкового состава плазмы крови рыб в норме и в условиях антропогенной нагрузки.
Целью работы явилось изучение влияния хронической интоксикации водной среды ионами кадмия на флуоресценцию аминокислотных остатков белков плазмы крови сеголеток карповых рыб.
Материалы и методы исследования
Работа выполнена на базе лаборатории молекулярной биологии кафедры биохимии и биофизики и лаборатории анатомии, физиологии, гистологии Дагестанского государственного университета. Экспериментальные исследования проводились в зимнее время (октябрь-ноябрь) 2012 г.
Материалом исследования послужили сеголетки карпа (Cyprinusсarpio L.), выращенные в прудах Широкольского рыбокомбината Тарумовского района республики Дагестан, которые отлавливались и переносились по 20-30 штук в аквариумы объемом 250-300 литров с содержанием хлорида кадмия 0,25 мг/дм3 (ПДК – 0,005 мг/дм3) [4]. Контролем во всех опытах служили рыбы, выдерживаемые в чистой воде. В аквариумах создавались условия постоянного температурного (19-23 °С) и газового режима. Кормили рыб живым трубочником Tubifextubifex.
На 5, 15, 30 и 40 сутки эксперимента регистрировали спектры собственной флуоресценции белков плазмы крови при возбуждении на длинах волн, которые соответствуют максимумам поглощения тирозина и триптофана (общая флуоресценция) (λвозб = 280 нм), и триптофана (λвозб = 295 нм).
Математический анализ полученных результатов исследования проводили в соответствии с общепринятыми правилами вариационной статистики. Среднестатистические спектры флуоресценции получали путем усреднения спектральных линий, полученных в повторных экспериментах (n=5). Для оценки достоверности различий использовали t-критерий Стьюдента. Обработку спектров производили в программах Origin 8.6.
Результаты исследования и их обсуждение
Результаты исследований представлены на графиках 1-4. Нами выявлены существенные различия в интенсивности флуоресценции в плазме крови сеголеток карпа при отравлении хлоридом кадмия. Установлено, что экспозиция сеголеток карпа в среде с 5 кратным превышением ПДК по кадмию, интенсивность общей (λвозб=280 нм) и триптофановой (λвозб=295 нм) флуоресценции белков плазмы крови на 5 сутки, существенно снижается относительно контроля (рис. 1). Дальнейшая экспозиция (15-30 дней) существенно не изменяет интенсивность общей флуоресценции. На 40 день интоксикации наблюдается значительное падение флуоресценции белков плазмы крови относительно контроля как при λвозб=280 нм, так и λвозб=295 нм (рис. 1, 2).
Анализ спектральных характеристик плазмы сеголеток карпа показал, что флуоресценция при возбуждении светом длиной волны 280 и 295 нм характеризуется значениями максимума интенсивности λмакс=330–336 нм. Для белков, содержащих триптофан и тирозин, положение максимума спектра флуоресценции не зависит от длины волны возбуждения, что свидетельствует о существенном вкладе в спектры триптофановых остатков [3].
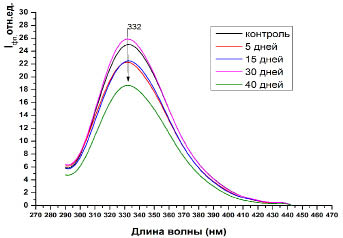
Рис. 1. Интенсивность собственной флуоресценции плазмы крови сеголеток карпа при возбуждении λвозб = 280 нм
Содержание белков в плазме крови рыб подвержено существенным изменениям. Для рыб допустимо пятикратное изменение концентрации плазменных белков (альбуминов и глобулинов), что абсолютно несовместимо с жизнью у птиц и млекопитающих. Спектр белков плазмы представлен типичными группами, т.е. альбуминами и глобулинами, однако, как физиологическая норма, у рыб в плазме обнаруживаются и другие белки – гемоглобин, гептоглобин.
При анализе спектров флуоресценции предпочтительно применять вторые производные спектров флуоресценции (2ПСФ) как наиболее информативные [15]. Использование 2ПСФ оправдано тем, что они, по сравнению с исходными спектрами, дают возможность получить более детальную информацию о состоянии микроокружения ароматических остатков белков, а в ряде случаев также и разделить вклад тирозиновой и триптофановой составляющих в суммарный спектр. Последнее обстоятельство обусловлено тем, что СФ триптофана имеют значительно большую полуширину в сравнении со спектрами флуоресценции тирозина и положение их максимумов по исходным спектрам может быть определено менее точно, чем в случае спектров поглощения [5]. Поэтому анализ 2ПСФ особенно актуален для анализа СФ белков, флуоресценция которых обусловлена преимущественно триптофановыми остатками.
Вторые производные спектров суммарной флуоресценции белков плазмы крови сеголеток карпа указывают о преобладающем вкладе триптофановых остатков в суммарной флуоресценции. Об этом свидетельствует положение отрицательно пика при 329 нм, наряду с которым обнаруживается плечо на 350 нм (рис. 2).
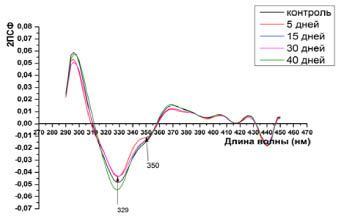
Рис. 2. Вторые производные собственной флуоресценции плазмы крови сеголеток карпа при возбуждении λвозб = 280 нм
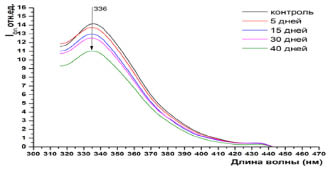
Рис. 3. Интенсивность собственной флуоресценции плазмы крови сеголеток карпа при возбуждении λвозб = 295 нм
Согласно гипотезе двух состояний, выдвинутой в работах [13], триптофановые остатки, находящиеся в контакте с водным растворителем, характеризуются положением максимума около 330 нм, а полностью доступные водному окружению – при 345–350 нм. В соответствии с этой классификацией, положение основного отрицательного максимума во 2ПСФ может быть отнесено к триптофановым остаткам, контактирующим с водным окружением, а пик при 350 нм к поверхностно локализованным остаткам триптофана.
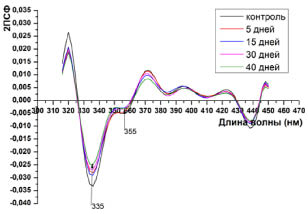
Рис. 4. Вторые производные собственной флуоресценции плазмы крови сеголеток карпа при возбуждении λвозб = 295 нм
Таким образом, изменениеинтенсивности общей и триптофановой флуоресценции плазмы крови сеголеток карпа при хронической интоксикации хлоридом кадмия, свидетельствуют об структурных изменениях в молекулах белков плазмы крови, которые могут быть как обратимыми, так и деструктивными, связанными с окислением триптофановых остатков и образованием битирозиновых сшивок.
В то же время, вторые производные спектров триптофановой флуоресценции (λвозб.= 280 и 295нм) белков плазмы крови не выявили существенных изменений при экспозиции сеголеток карпа в среде с превышением ПДК по хлориду кадмия (рис. 2, 4) относительно контроля.
Полученные данные служат важным информативным показателем оценки изменений, наблюдаемых на организменном или видовом уровнях гидробионтов.
Несмотря на то, что оценка процесса антропогенной деградации водных объектов требует дальнейшей разработки и должна носить комплексный характер, предложенная нами система оценки является достаточно универсальной и позволяет использовать ее в качестве объективного, наиболее экономичного экспресс – метода для оценки состояния гидробионтов, экологического мониторинга и экологических экспертиз водных экосистем.
Статья подготовлена при поддержке Министерства образования и науки РФ, соглашение № 14.В37.21.0192.

