Введение
Взаимоотношения опухоли и организма-опухоленосителя реализуются на организменном, органном, межклеточном, молекулярном уровнях. Важнейшим звеном этих взаимодействий является иммунная система с врожденными и адаптивными факторами, находящимися как в периферической крови, так и в опухолевой ткани. При исследовании противоопухолевого иммунитета обычно изучают общие (системные) клеточные и гуморальные факторы, определяемые в крови, что с учетом рециркуляции лимфоцитов [6, 7] представляется оправданным, но недостаточным, поскольку решающим для элиминации антигена является эффекторное звено, находящееся в очаге [2, 13]. Несмотря на то, что феномен инфильтрации опухоли иммунокомпетентными клетками давно известен, в современной литературе их роль расценивается неоднозначно, т.к. они благодаря продукции цитокинов и факторов роста могут способствовать не только ее регрессии, но и росту и метастазированию [1, 8, 11, 14].
По-видимому, состав иммунокомпетентных клеток, присутствующих в опухоли, формируется в результате влияния как самой опухоли, так и ее окружения [1, 2]. Ранее нами были показаны различия лимфоцитарного микроокружения для опухолей толстой кишки: доброкачественных (полипов) и злокачественных (рака) [3, 15], а также для первичных и метастатических опухолей печени [4]. Соседствующая с опухолью перитуморальная область может не только влиять на развитие опухоли, но и в свою очередь подвергаться ее влиянию, приобретая сходство с самой опухолью по метаболическим особенностям [5], что делает ее перспективным объектом и для иммунологического исследования. Факторы клеточного иммунитета, потенциально препятствующие или способствующие развитию опухоли и находящиеся в различных немалигнизированных тканях, также недостаточно исследованы. Так, если довольно подробно изучен состав иммунокомпетентных клеток толстой кишки в норме и при различных заболеваниях [6, 7, 13], то присутствии в ткани и опухолях желудка некоторых лимфоцитарных субпопуляций имеются только единичные сообщения [10].
Итак, изучение особенностей локального иммунитета и его изменений при развитии злокачественных опухолей представляет собой важную, но недостаточно проясненную проблему, значимую для понимания их патогенеза, а также возможного прогноза и лечения.
Целью работы является выявление влияния гистологического строения опухоли и особенностей ее органного окружения на факторы локального клеточного иммунитета у больных раком желудка и толстой кишки.
Материалы и методы
В исследование были включены 48 больных с местно-распространенным (III стадия) раком желудка (РЖ) и толстой кишки (РТК), у которых первым этапом лечения выполнялась операция. У 18 больных (возраст 36 - 76 лет) были диагностированы первичные спорадические аденокарциномы толстого кишечника, у 30 (возраст 38 - 68 лет) - рак желудка, из них у 18 при гистологическом исследовании была выявлена аденокарцинома, у 9 перстневидноклеточный рак (ПКР), у 3 недифференцированный рак (НДР). В ходе оперативных вмешательств проводили удаление опухолевого очага с дальнейшим исследованием ткани опухоли, а также визуально неизмененных участков ткани на расстоянии 1-3 см (перитуморальная зона) и 7-10 см (линия резекции) от края опухоли. Полученные образцы ex temporaе гомогенизировали в среде 199. Иммунофенотипирование лимфоцитов периферической крови и образцов тканей, проводили с помощью панели моноклональных антител T-B-NK (CD3, CD4, CD8, CD19, CD16, CD56), методом проточной цитофлюориметрии на цитофлюориметре FacsCanto II BD. Статистическую обработку результатов выполняли с использованием параметрических и непараметрических методов (t-критерия Стьюдента, z-критерия знаков, критерия Уилкоксона).
Результаты и обсуждение
Результаты представлены в табл. 1-3 и на рис. 1. В периферической крови по изученным иммунологическим показателям больных РТК и РЖ различий не отмечено (рис. 1).
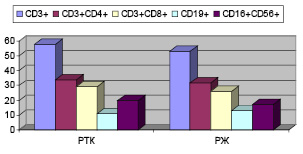
Рис. 1. Субпопуляции лимфоцитов периферической крови больных аденокарциномой
толстой кишки и желудка
РТК – рак толстой кишки; РЖ – рак желудка
Таблица 1
Субпопуляции лимфоцитов тканей больных аденокарциномой толстой кишки и желудка
|
Опухоли |
Образцы тканей |
Субпопуляции лимфоцитов, % |
||||
|
CD3+ |
CD3+CD4+ |
CD3+CD8+ |
CD19+ |
CD16+/56+ |
||
|
РТК (n=18) |
Опухоль |
61,2± 3,5 ** ■ |
33,0± 3,0* ** |
26,9± 4,5■ |
24,1± 5,2** |
12,4± 3,5■ |
|
Перитумо-ральная зона |
47,6± 5,1 |
21,4± 3,8 |
21,0± 5,1 |
43,64± 7,6■ |
10,8± 3,0■ |
|
|
Линия резекции |
49,0± 7,5 |
21,4± 4,1■ |
26,5± 6,6 |
35,8± 5,3 |
13,9± 4,9 |
|
|
РЖ (n=18) |
Опухоль |
48,0± 1,73* ** ■ |
36,3± 1,8** |
10,1± 1,4* ** ■ |
29,8± 1,2* ** ■ |
21,2± 1,0*■ |
|
Перитуморальная зона |
57,9± 1,93 |
28,2± 1,4 |
27,4± 1,2 |
16,8± 1,07*■ |
23,2± 3,85*■ |
|
|
Линия резекции |
62,7± 2,2 |
35,3± 1,67** ■ |
23,6± 1,27 |
21,4± 1,87**■ |
8,22± 1,0** |
|
Примечание * - статистически достоверные отличия от линии резекции; ** - статистически достоверные отличия от перитуморальной зоны; ■- статистически достоверные различия между РТК и РЖ (Р<0,05)
В отличие от крови, при исследовании образцов тканей были установлены статистически достоверные различия в зависимости от локализации аденокарциномы (табл. 1). Так, в ткани опухоли толстой кишки содержится больше Т-лимфоцитов, чем в опухолевой ткани желудка, и это различие связано с низким содержанием в последней CD3+CD8+ клеток. При этом в ткани аденокарциномы желудка оказалось в 2 раза более высокое содержание NК-клеток по сравнению с аденокарциномой толстой кишки. В перитуморальной зоне также обнаружен ряд различий, а именно, в образцах опухолей толстой кишки отмечено более высокое содержание В-лимфоцитов и более низкое – NК-клеток. Линия резекции, характеризующая немалигнизированную ткань органа, также имеет различия по содержанию в ней лимфоцитарных субпопуляций: в ткани желудка выявлено статистически достоверно более высокое количество СD3+СD4+ клеток и более низкое В-лимфоцитов по сравнению с тканью толстой кишки.
Результаты, характеризующие факторы локального иммунитета при опухоли одного органа, но с различным гистологическим строением, представлены на примере аденокарциномы в сравнении с перстневидно-клеточным и недифференцированным раком желудка в табл. 2. Данные по ПКР и НДР были суммированы, т.к. для этих опухолей характерно сходное и в целом более неблагоприятное клиническое течение, чем для аденокарциномы.
Как видно из данных, представленных в табл. 2, в ткани опухоли статистически достоверные различия наблюдались только по одному параметру: уровню зрелых Т-лимфоцитов (CD3+), который был выше при аденокарциноме, чем при ПКР и НДР. Состав лимфоцитов перитуморальной области не имел статистически достоверных различий, однако они были обнаружены в ткани, взятой по линии резекции: при аденокарциноме по сравнению с ПКР/НДР уровень СD3+ клеток был выше, по-видимому, за счет СD3+СD8+ лимфоцитов.
Сравнительная характеристика состава лимфоцитов, содержащихся в исследованных образцах тканей, представлена в табл. 3
Сопоставляя приведенные в табл. 3 различия состава лимфоцитов при опухолях различного гистотипа в одном органе и опухолях одного гистотипа в разных органах, можно отметить превалирующее значение органного окружения, по-видимому, обеспечивающего особенности формирования локальных иммунных реакций с преобладанием тех или иных лимфоцитарных субпопуляций.
Таблица 2
Субпопуляции лимфоцитов в образцах тканей желудка
при различном гистотипе опухоли
|
Показатель, % |
Группы больных |
|||||
|
Аденокарцинома (n=18) |
ПКР, НДР (n=12) |
|||||
|
опухоль |
перитуморальная зона |
линия резекции |
опухоль |
перитуморальная зона |
линия резекции |
|
|
CD3+ |
48,0±1,7* |
57,9±1,9 |
62,7±2,2* |
42,9±1,5* |
55,2±0,6 |
56,9±1,0* |
|
CD3+CD4+ |
36,3±0,8 |
28,2±1,4 |
35,3±1,7 |
35,3±0,6 |
25,3±1,4 |
39,0±1,8 |
|
CD3+CD8+ |
10,1±0,4 |
27,4±1,2 |
23,6±1,2* |
8,7±0,8 |
27,8±1,7 |
16,6±1,2* |
|
CD19+ |
29,8±1,2 |
16,8±1,1 |
28,0±1,3 |
29,6±0,7 |
17,5±1,6 |
30,1±0,9 |
|
CD16+CD56+ |
21,2±1,0 |
21,4±1,9 |
8,3±1,0 |
23,2±2,1 |
24,9±1,6 |
10,6±1,4 |
Примечание. * - статистически достоверные отличия в зависимости от гистотипа (Р<0,05)
Таблица 3
Количество статистически достоверных различий
между содержанием субпопуляций лимфоцитов в образцах тканей
|
Образцы тканей |
РЖ и РТК аденокарцинома |
РЖ аденокарцинома и ПРК/НДР |
|
Опухоль |
3 (CD3+, CD3+CD8+, CD16+CD56+) |
1 (CD3+) |
|
Перитуморальная зона |
2 (CD19+, CD16+CD56+) |
0 |
|
Линия резекции |
2 (CD19+, CD3+CD4+) |
2 (CD3+, CD3+CD8+) |
Итак, установлены различия содержания факторов локального клеточного иммунитета, присутствующих в микроокружении аденокарциномы при ее развитии в разных органах желудочно-кишечного тракта. Аденокарцинома желудка характеризуется преобладанием в ней цитотоксических лимфоцитов, ответственных за врожденный иммунитет (NК), над участвующими в реакциях адаптивного иммунитета (СD3+СD8+). Интересно, что в перитуморальной зоне и в ткани линии резекции при аденокарциноме желудка количество СD3+СD8+ клеток существенно выше, чем в опухолевом очаге, и это также отличает ее от микроокружения опухоли того же гистотипа в толстой кишке. Противоположная ситуация наблюдается по NК и В-лимфоцитам: количество NК, одинаковое в непораженной ткани толстой кишки и желудка, при РЖ концентрируется в перитуморальной зоне и в опухоли. Напротив, содержание В-клеток в неизмененной ткани толстой кишки и ее перитуморальной области выше, чем в ткани самой опухоли, что соответствует представлениям о развитом В-клеточном звене иммунитета именно в толстой кишке, имеющей высокую антигенную нагрузку [6, 7].
Заключение
Выявленные особенности локального иммунитета при раке желудка и толстой кишки могут быть связаны с явлением органоспецифичности, описанной I.J. Fidler (2002) [9] при характеристике различий активности опухолевых клеток в разных органах в зависимости от складывающихся в них условий (особенностей клеточного состава, цитокинового баланса, наличия или отсутствия биологически активных веществ медиаторной или гормональной природы, состояния экстрацеллюлярного матрикса, сосудистой сети, микрофлоры, генерации активных форм кислорода и пр.). Наши данные свидетельствуют о том, что органоспецифичность может проявляться не только в плане способности опухолевых клеток приживляться и экспрессировать гены, обеспечивающие их пролиферативный и метастатический потенциал [12], но и в отношении формирования определенного лимфоцитарного микроокружения опухоли с преобладанием факторов врожденного или адаптивного иммунитета.

