Посттравматическое восстановление скелетных мышц является актуальной медико-биологической проблемой. Как правило, после глубоких мышечных повреждений полноценного восстановления ткани не происходит. На его месте формируется грубоволокнистый рубец, что приводит к нарушению функционирования органа. Существующие технологии коррекции данных дефектов – мышечная аутопластика, аллопластика, ксенопластика, клеточные технологии, генная терапия являются трудоемкими, травматичными и сопряжены с осложнениями [1]. Одним из перспективных направлений в регенеративной медицине являются тканевая инженерия с использованием биодеградируемых трансплантатов [3]. Биоматериалы Аллоплант в различной модификации зарекомендовали себя как эффективные стимуляторы регенерации соединительной ткани [6]. Целью исследования явилось определение морфологических аспектов регенерации скелетной мышечной ткани после механического повреждения с использованием одного из его видов – аллогенного губчатого биоматериала (АГБ).
Материалы и методы исследования
Для исследования использовали половозрелых крыс породы Вистар. Работу проводили с соблюдением «Правил проведения работ с использованием экспериментальных животных» (приказ Минвуза от 13 ноября 1984 г. № 724). В опытной серии (n=36) после разреза кожных покровов на задней поверхности голени производилось выделение икроножной мышцы и пяточного сухожилия, а также малоберцового нерва, который не повреждали. Затем на брюшко мышцы в средней трети наносили дефект длиной 3–4 мм. В толщу между проксимальной и дистальной культями укладывался АГБ соответствующих размеров и фиксировался нитевидным сухожильным трансплантатом. В контрольной серии (n=36) в области икроножной мышцы был нанесен дефект длиной 3-4 мм. После чего на кожу в обоих случаях накладывали швы Vicryl 6–0. Малоберцовый нерв не повреждали. АГБ был изготовлен в данном случае из сухожилий крысы и обработан методом лиофилизации, что позволяет добиться модификации структуры в губчатую форму с увеличением объема в 6 раз [7]. Нитевидный сухожильный трансплантат, также был аллогенного происхождения, изготовлен из сухожилия крысы и представлял собой нить, которая применялась для фиксации трансплантируемого АГБ к культям мышцы. Из опыта животные выводились путем инсуфляции летальной дозы паров раствора фторотана. Забор биопсийного материала проводили через 3, 7, 14, 30, 60 и 90 суток после эксперимента. Все трансплантаты были обработаны по оригинальной запатентованной технологии АллоплантÒ, разработанной в ФГБУ «Всероссийский центр глазной и пластической хирургии МЗ РФ» (Патент РФ на изобретение № 2189257, ТУ 9398-001-04537642-2011). Гистологические срезы тканей окрашивали гематоксилином и эозином, по Ван Гизону и по Маллори. Микроскопические исследования проводились с использованием светового микроскопа AxioImager Z1, оснащенного фотонасадкой ProgRes C3 и программой анализа изображений Axiovision (C. Zeiss, Германия). Для электронномикроскопического исследования кусочки тканей фиксировали в 2,5 %-м р-ре глютаральдегида, приготовленного на какодилатном буфере (рН 7,2–7,4) с дофиксацией в 1 %-ном р-ре OsO4 на том же буфере. Материал обезвоживали в спиртах возрастающей концентрации и заливали в эпон-812 по общепринятой методике. Предварительно готовили полутонкие срезы на ультратоме ЕМ UС 7 (Leica, Германия) и окрашивали их раствором толуидинового синего на 2,5 %-ном р-ре безводной соды. На данных срезах выбирали участки для электронномикроскопического исследования. Ультратонкие срезы контрастировали 2 %-ным водным р-ром уранилацетата, цитратом свинца по Рейнольдсу и изучали в трансмиссионном микроскопе JEM-1011 (Jeol, Япония) при ускоряющем напряжении 80 кв.
Результаты исследования и их обсуждение
В контрольной группе в начальные сроки в ране обнаруживались очаги острого воспаления и кровоизлияния. В период 7-14 суток отмечалось развитие пролиферативной стадии воспаления. Дефект замещался грануляционной тканью, представленной толстыми фуксинофильными пучками коллагеновых волокон, инфильтрированных соединительнотканными и иммуногенными клетками. Среди клеток соединительной ткани преобладали клетки фибробластического ряда: мезенхимные клетки, фибробласты с активной коллагенсинтетической деятельностью (коллагенобласты II типа). В меньшей степени выявлялись лимфоциты, макрофаги, преимущественно секреторного типа, и их производные – эпителиоидные клетки и гигантские клетки инородных тел. Отмечался скудный васкулярный рисунок. Резецированные мышечные волокна запечатывались коллагеновыми волокнами за счет наплыва сарколеммы. Через 21 сутки в месте дефекта выявлялись признаки трансформации грануляционной ткани в жировую за счет терминальной дифференцировки фибробластов в адипоциты. В цитоплазме фибробластов помимо характерных резко расширенных каналов гранулярного эндоплазматического ретикулюма выявлялись многочисленные разнокалиберные липидные капли (рис. 1).

Рис. 1. Фибробластическая клетка адипоцитарного направления с хорошо развитой сетью ГЭР. Через 21 сутки после нанесения дефекта в скелетной мышечной ткани. Электронограмма. Увеличение х6000
Спустя 30 суток в области дефекта обнаруживался регенерат, состоящий из мышечной, жировой и плотной волокнистой соединительной тканей (рис. 2).
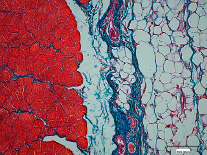
Рис. 2. Жировое перерождение соединительной ткани через 30 суток после нанесения дефекта в скелетной мышечной ткани. Окраска по Маллори
В контрольной группе стадия острого воспаления переходила в фазу пролиферации с образованием гранулематозной ткани, где была наиболее усилена фибробластическая деятельность. Выраженная мезенхимная реакция и дифференциация в коллагенобласты II типа способствовала интенсивному синтезу коллагеновых волокон. Выявлялся их дефицит и дифференциация в неактивные гигантские формы с низкой секреторной активностью. Известно, что фенотипическая незрелость и фагоцитарная инертность макрофагов могла способствовать незавершенному фагоцитозу и привлечению лимфоидных клеток, что обуславливало фиброзирование дефекта в мышечной ткани [2]. Происходила редукция гемокапилляров. Ишемия тканей могла способствовать распаду мышечных волокон и массовой гибели клеток, что также провоцировало развитие фиброза [2]. Результатом заживления мышечного дефекта явилось образование рубца с последующим перерождением в жировую ткань.
В опытной группе через 3 суток после пересадки АГБ в паратравматической зоне обнаруживались дилятация и повышенная проницаемость кровеносных сосудов, нейтрофильная инфильтрация, отек межпучковых пространств, разрушения миоцитов, кровоизлияния. В зоне трансплантата выявлялся фуксинофильный тканевый экссудат, пронизанный фибриновыми нитями в виде тонковолокнистой сети. Признаки острого воспаления были обусловлены механическими воздействиями, возникшими вследствие оперативного вмешательства. Проницаемость кровеносных сосудов способствовала клеточной элиминации, набуханию и ферментативному воздействию на трансплантат. Через 7 суток воспалительная инфильтрация в реактивной зоне и в самом трансплантате менялась на макрофагально-фибробластическую. Выявлялись макрофаги фагоцитарного типа, а фибробласты с умеренно расширенными каналами гранулярного эндоплазматического ретикулюма классифицировались как коллагенобласты I типа – клетки с умеренным синтезом коллагена. Наряду с соединительнотканными клетками обнаруживались малодифференцированные клетки без определенной специализации, а также клетки миогенной дифференциации – миосателлитоциты II типа и миобласты. После лизиса и резорбции балок АГБ макрофагами происходило постепенное разрастание обильно васкуляризированной рыхлой неоформленной соединительной ткани. Спустя 14 суток происходило замещение АГБ от периферии до центра по всей площади. Наблюдались признаки формирования мышечно-соединительнотканного регенерата с преобладанием рыхлой соединительной ткани. Регенерат был представлен тонкими пучками коллагеновых волокон инфильтрированных макрофагами и фибробластами. Причем, макрофаги присутствовали в наибольшем количестве. Строму сопровождали гемокапилляры, свободные миоциты, образующие почки роста и тяжи новообразованных тонких мышечных волокон (рис. 3).
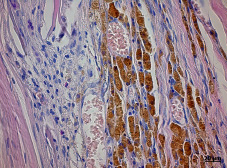
Рис. 3. Массивная инвазия макрофагов в центральной зоне через 14 суток после имплантации в скелетную мышцу крысы губчатого аллотрансплантата. Окраска гематоксилином и эозином
Через 30 суток в очаге трансплантации обнаруживался мышечно-соединительнотканный регенерат с преобладанием мышечной ткани. Пространственная ориентация растущих миосимпластов была параллельна балкам предсуществующего биоматериала. Через 60 – 90 суток регенерат был представлен пучками мышечных волокон окутанных эндо- и перимизием (рис. 4).
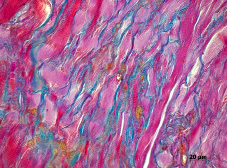
Рис. 4. Новообразованная мышечная ткань в зоне трансплантации губчатого аллотрансплантата спустя 90 суток. Параллельно ориентированные пучки мышечных волокон окутаны эндо- и перимизием. Окраска по Маллори
Биоматериалы Аллоплант изготавливаются из волокнистых соединительнотканных кадаверных тканей. После их имплантации при замещении у реципиента формируется собственная органотипическая рыхлая волокнистая соединительная ткань [5, 6], что подтверждает данное исследование. Между расширенными стромальными элементами свободно мигрировали эндотелиальные клетки гемокапилляров и малодифференцированные миогенные клетки. Продукты резорбции АГБ являются хемоаттрактантами макрофагов и способствуют их фенотипическому созреванию в клетки фагоцитарного типа [5], что наблюдалось в опытной группе. Активированные макрофаги, в свою очередь, влияют на фенотипизм фибробластов, которые ингибируют избыточный синтез коллагена. По данным исследователей, макрофаги также способствуют успешному приживлению миогенных клеток предшественников в раннем периоде заживления скелетной мускулатуры [8, 9, 10]. Происходила ранняя активация миосателлитоцитов и их дифференциация в зрелые миоциты. Новообразованные миосимплаты сопровождали коллагеновые волокна и свободно проникали между ними. За счет удлинения и гипертрофии мышечных волокон, они постепенно вытесняли новообразованную рыхлую соединительную ткань на периферию мышечного пучка. Так формировался эндомизий и перимизий. В данном случае, соединительная ткань выступает «в качестве источника индукционно-формативной тканевой регуляции», а мышечная ткань является регулируемой системой [4].
Таким образом, при использовании АГБ наблюдалось восстановление скелетной мышечной ткани на месте утраченной, в то время как в контрольной группе без применения биоматериала происходило формирование неполноценного соединительно-жировотканного регенерата.

