В процессе изучения химии достаточно много времени затрачивается на проведение расчётов. В работе [1] показано использование языка С# для нахождения корней химического уравнения. В химическом уравнении обозначаются коэффициенты как переменные:
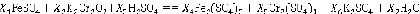
Составляется система линейных уравнений. Число уравнений равно числу элементов, участвующих в реакции. Например, для железа:
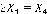
И так для каждого элемента. Пользователь вводит элемент и уравнение для этого элемента. Программа вычисляет значения корней-коэффициентов.
Пользователь расставляет значения коэффициентов:
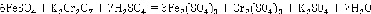
Использование компьютерных технологий позволяет уменьшить время на осуществление расчётных этапов обучения, выполнения самостоятельной работы, проверки контрольных работ.
Целью нашей работы являлось продолжение использования компьютерных технологий в обучении, выполнении самостоятельной, лабораторных работ.
С этой целью составлена программа на языке С# для нахождения зависимости изменения электродного потенциала от концентрации соответствующего иона в растворе, от величины температуры, рН системы.
В качестве базы данных в программе использованы справочные данные [2].
После включения программы (Рис. 1) пользователь должен указать электрод (Рис. 2), который находится в растворе соли этого металла.
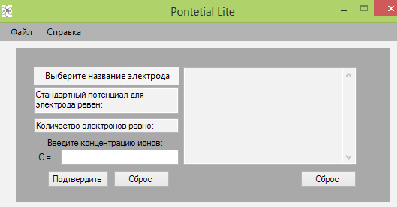
Рис. 1. Начало работы
Пользователь указывает концентрацию, для которой необходимо найти значение электродного потенциала.
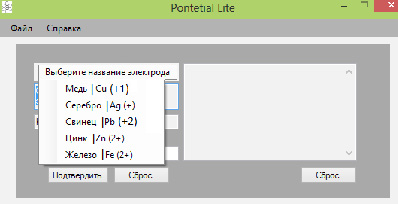
Рис.2. Выбор электрода
После этого на экране появляется значение стандартного электродного потенциала (Рис.3).
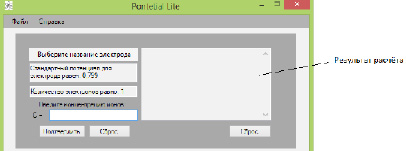
Рис. 3. Расчёт стандартного электродного потенциала для разных концентраций иона в растворе
Для расчёта электродного потенциала по уравнению Нернста при стандартных условиях достаточно ввести концентрацию соответствующего иона в растворе, подтвердить указанный параметр и результат демонстрируется в правом окне (Рис.3). Программа позволяет получить результаты для нескольких концентраций, построить графическую зависимость изменения величины потенциала от концентрации иона в растворе при стандартных условиях, для разных температур, разных рН раствора.

