Инфракрасная спектроскопия (ИК-спектроскопия) – раздел спектроскопии, который включает в себя получение и изучение инфракрасных спектров. ИК-спектроскопия занимается главным образом изучением молекулярных спектров испускания, поглощения и отражения, так как в инфракрасной области расположено большинство колебательных и вращательных спектров молекул. В минералогии и кристаллографии инфракрасная спектроскопия применяется для идентификации и количественного анализа смесей минералов; для определения природы H2O в структуре минералов; выяснения степени упорядоченности структур, как критерия их образования, а также для изучения структурных преобразований, связанных с изменением координации отдельных атомов (Al, Ti, Ge) в структуре минералов. Метод инфракрасной спектроскопии позволяет определить состояние воды в минерале, характер аморфных примесей, степень структурной упорядоченности, отнесение минерала к определенному структурному типу и др.
Кратко остановимся на теории данного метода. Согласно второму постулату Бора, энергия поглощаемого фотона равна разности энергий стационарных состояний: hvkn = Ek – En. При этом происходят изменения энергии электронов, колебания атомных ядер и энергия вращения молекулы.
Происхождение молекулярных спектров связано с изменением внутренней энергии молекул, которая включает в себя все виды внутренней энергии атомов, составляющих молекулу, а также все внутренние энергии, присущие молекуле в целом.
Оптические спектры молекул получаются при изменении трех видов внутренней энергии: энергии электронов; энергии колебания атомов в молекуле относительно некоторого положения равновесия; энергии вращения всей молекулы, подобно волчку, вокруг своей собственной оси, то есть Е = Еэл + Ек + Евр.
Каждому из этих видов внутренней энергии для молекул данного вещества соответствует свой набор энергетических уровней. Расстояние между уровнями, их количество и относительное расположение полностью определяется строением молекулы вещества. Возбуждая тот или иной вид внутренней энергии молекул, получают молекулярные спектры, которые можно классифицировать следующим образом. По характеру изменения внутренней энергии при поглощении или испускании молекулами фотонов электромагнитного излучения. Они разделяются на: вращательные, колебательные и электронные. Инфракрасной области спектра соответствуют волновые числа колебательных квантов – от 30 до 4000 см-1.
Энергия поглощенного осциллятором кванта равна:
hv = En+1 – En =
= hv 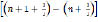
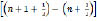 = hv –
= hv –
формула справедлива только для малых колебаний ядер.
Интенсивность линий в спектре поглощения пропорциональна квадрату изменения дипольного момента. В то же время в отличие от гармонического осциллятора переход с Δn = 1 оказывается не единственно возможным, но лишь наиболее вероятным, и при поглощении и излучении возможны так же переходы с Δn = 2, 3, 4, …
При комнатной температуре почти все молекулы находятся в основном колебательном состоянии (n = 0). Частоты переходов с нулевого уровня на первый, второй, третий и т.д. равны: v1 = v (1–2 xe), v2 = 2v (1–3xe), v3 = 3v (1–4xe).
Первая линия в спектре имеет частоту, близкую к предсказываемой теорией гармонических колебаний. Её называют фундаментальной или основной. Она более яркая, так как этот переход вероятнее всего. Вторую, третью и другие частоты называют обертонами, их интенсивность уменьшается с ростом n. Разность частот между двумя соседними полосами уменьшается, и они сходятся к частоте vmax, в результате чего возникает сплошной спектр поглощения.
Измеряя частоты поглощения электромагнитного излучения двухатомных молекул в инфракрасной области, можно рассчитать такие параметры молекул, как частоту колебаний атомов, силовую постоянную k, характеризующую энергию связи, момент инерции, частоту вращения и расстояние между атомами.
Межмолекулярное взаимодействие влияет на ИК-спектр вещества. Это взаимодействие изменяет уровни энергии молекулы и приводит к исчезновению вращательной структуры, расширению полос и к смещению частот в спектре. Особое влияние на ИК-спектр оказывает водородная связь. При образовании межмолекулярной водородной связи группы ОН одной молекулы с электроотрицательным атомом А другой молекулы: О–Н…А происходит ослабление связи О–Н, в результате чего характеристичная частота валентного колебания А–Н уменьшается, что сопровождается расширением полосы.
С ростом температуры протон, переходя в возбужденное состояние, будет находиться на более высоких энергетических уровнях.
В данном случае возможно построение физической модели для процесса дегидроксилации минералов.
Процесс делокализации (дегидроксилации) протона с позиции квантовой механики рассматривается как его переход в возбужденное состояние. В рамках такого первоначального подхода протон не имеет возможность переходить от одного атома кислорода к другому. Поведение микрочастицы (в протоне) соответствует волновому уравнению Шрёдингера, полностью определяющего ее движение. В квантовой механике движение частицы не может быть точно определено, а определяется некоторой вероятностью ее локализации в пространстве при помощи волновой функции Ψ(х). Волновая функция является решением стандартного уравнения Шредингера.
В классической механике полная энергия системы характеризуется функцией Гамильтона Н, полная энергия равна: Н = T + U.
В квантовой физике состояние объекта описывается волновой функцией (и для физических задач используется уравнение Шрёдингера).
Анализ такого рода модели базируется на нахождении энергетического спектра, соответствующего уравнению Шрёдингера:
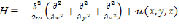
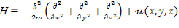 ,
,
или
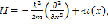
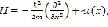
где
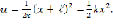
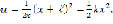
Результатом такого расчета будет определение степени делокализации протона в данной системе. Эта модель позволяет выявить дополнительные особенности процесса дегидроксилации в ряде минералов и понять сам механизм дегидроксилации.

