Введение
Метамерия и сегментация тела играют важную роль в жизнедеятельности животных [6,10,11,14]. Метамерия состоит в повторении внутренних органов по длинной оси тела животного, от нее не всегда отличают внешнюю сегментацию [14]. Н.А. Ливанов заметил, что «…метамерия представляет явление сложное, которое в известной мере – во «внешней» метамерии, может быть связано с движением животного и с выработкой локомоторных придатков, параподий, а во всей полноте будет раскрыто… при анализе «внутренней» метамерии тела» [7]. По мнению Л.А. Зенкевича, одним из важных условий возникновения метамерии тела является уплотнение наружных покровов тела, что усиливает защиту животного, но ограничивает подвижность тела. Противоречие снимает образование эластичных межсегментных соединений [14]. А. Ланг считал, что тело животного разделяется на метамеры, благодаря появлению тех или иных органов, метамерное расположение которых полезно животному: в связи с его змеевидными движениями (придатки для ползания) или с необходимостью увеличить плодовитость (повторное расположение гонад), или с потребностью улучшить условия кровообращения (повторное расположение анастомозов между главными продольными сосудами). Следствием метамерии отдельных органов является метамерия мезодермы и разделение ее на сомиты уже в эмбриогенезе [14]. П.П. Иванов [4] разделил метамеры на ларвальные (головные, челюстные), связанные с фукциями нащупывания и захвата субстрата, зарывания в грунт, и постларвальные (туловищные). В отличие от П.П. Иванова, В.Н. Беклемишев [1] считал метамерию результатом приспособления животного не к локомоции, а к размножению. Поэтому ларвальные сегменты лишены полового аппарата. Согласно П.П. Иванову [4], постларвальная сегментация тела у вторичноротых животных возникает вследствие дополнительной, но не полной сегментации заднего или туловищного отдела тела путем повторного образования некоторых органов, например гонад, или путем метамерных сужений и расширений продольных органов, например образования печеночных выступов и перехватов между ними в кишечнике. Под это определение подпадает морфогенез центральных краниальных брыжеечных лимфоузлов [9].
Механизм формирования сомитов в эмбриогенезе остается неизвестным, его изучение не выходит за чисто описательный уровень, хотя и проведено уже немало различных экспериментов [3,5]. Разные авторы указывают на влияние хорды и нервной трубки, гензеновского узелка и боковой пластинки мезодермы. A.M. Turing (1952) математически показал, что распространение какого-либо метаболита на протяжении аксиальной мезодермы носит волнообразный характер, из чего некоторые эмбриологи сделали вывод о существовании каких-то веществ, обладающих морфогенетическим давлением. Однако результаты ряда опытов на зародышах амфибий отрицают существование каких-либо влияний, передающихся от головного конца дорсальной мезодермы к ее хвостовому концу, регулирующих ее сегментацию. Возможно сегментация аксиальной мезодермы не зависит от какого-либо регуляторного сигнала, исходящего от головного участка, а может начаться в любой точке по оси зародыша независимо от участков, лежащих кпереди от нее. При этом не исключена возможность, что в каждом изолированном отрезке оси зародыша инициируется новый кранио-каудальный регулирующий механизм [3].
Цель исследования: рассмотреть возможную роль общеизвестных процессов эмбрионального органогенеза в образовании сомитов.
Материал и методы исследования
Работа проведена на 30 эмбрионах человека 4-8 нед. (5-30 мм теменно-копчиковой длины). После фиксации в жидкости Буэна материал заливали в парафин с последующим изготовлением серийных срезов толщиной 5-7 мкм в трех основных анатомических плоскостях. Срезы окрашивали гематоксилином и эозином, смесью Маллори, альциановым и толуидиновым синими при рН = 1,0-5,0 под ферментативным контролем.
Результаты исследования их обсуждение
В еще несегментированной аксиальной мезодерме эмбриона человека определяются сгущения клеток. Быстро растущие кластеры все более темных клеток разделяются постепенно утолщающимися прослойками более светлых клеток: цепь сомитов удлиняется, последовательно присоединяя новые звенья, в которых клетки приобретают радиальную ориентацию. У амфибий они описаны как розетки, в их пределах аффинитет между мезодермальными клетками выше, чем между соседними розетками [3]. Образование сомитов происходит с конца 3-й нед и до начала 6-й нед [12]. В эти сроки наблюдается скручивание тела эмбриона вокруг продольной оси в процессе интенсивного каудального удлинения эмбриона, плавающего вокруг сужающегося зародышевого ствола, в окружении уплотняющихся оболочек. Эмбрион до фиксации освобождают от стягивающих при фиксации оболочек, чтобы получить его недеформированные срезы. На 6-й нед заметно накопление протеогликанов в зачатках позвонков. Охрящевление туловищного скелета ясно выражено на 7-й нед, когда прекращается кручение эмбриона, которое, видимо, с 4-5 нед тормозят сердце и печень, интенсивно растущие в каудальном направлении.
Наиболее интенсивно сомитообразование происходит у эмбриона человека 4-й нед [12]. Обособление закладки любого органа в эмбриогенезе сопряжено с формированием его автономного сосудистого русла. В литературе [12,13] сообщается лишь, что дорсальные ветви дорсальной аорты идут по обе стороны от нервной трубки, в рыхлую мезенхиму между сомитами – межсегментарные артерии. Им после рождения соответствуют межреберные и поясничные артерии. В конце 4-й нед новообразование поясничных сомитов наблюдается дорсокаудальнее бифуркации аорты (рис. 1-3).
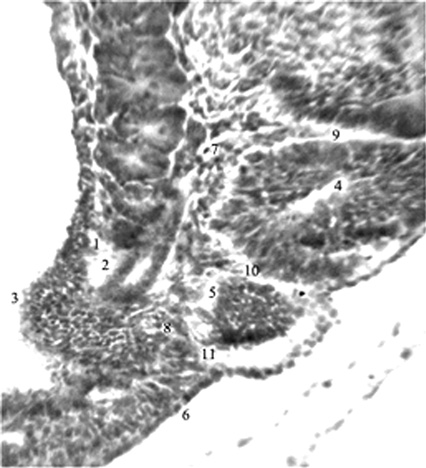
Рис. 1. Эмбрион человека 5 мм длины (4 недель), сагиттальный срез: 1,2 – вещество и проток мезонефроса; 3 – метанефрогенная бластема; 4,5 – поясничные сомиты на разных этапах развития; 6 – недифференцированная
дорсальная мезодерма; 7,8 – протоковая вена
и ее корни; 9-11 – межсомитные сосуды.
Гематоксилин и эозин. Ув. 200.
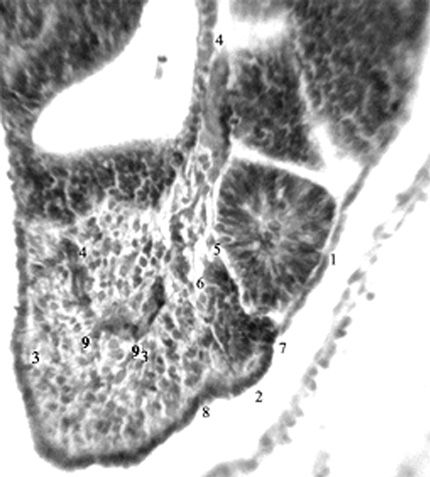
Рис. 2. Эмбрион человека 5 мм длины (4 недель), сагиттальный срез: 1-2 –сомиты на разных этапах морфогенеза; 3-3 – несегментированная аксиальная мезодерма; 4-4 – протоковая вена; 5,6 – межсомитные сосуды; 7,8 – межсомитные борозды; 9 – ветви протоковой вены,
внедряющиеся в аксиальную мезодерму.
Гематоксилин и эозин. Ув. 200.
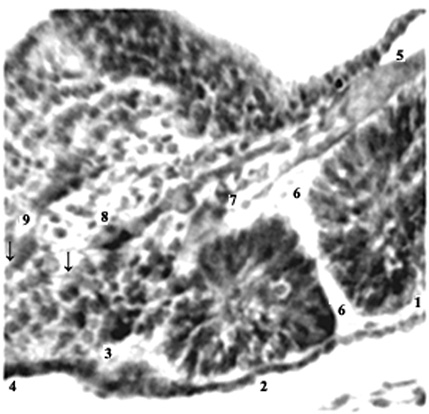
Рис. 3. Эмбрион человека 5 мм длины (4 недель), сагиттальный срез: 1,2 – сомиты; 3,4 – сегментация недифференцированной дорсальной мезодермы (новообразование сомитов);
5 – протоковая вена; 6-9 – межсомитные сосуды. Стрелки указывают на светлые клинья
мезенхимы и микрососуды, внедряющиеся
в тяж дорсальной мезодермы.
Гематоксилин и эозин. Ув. 300.
В этой области, между протоком мезонефроса (вентрально) и сомитами (дорсально) проходит протоковая вена, вентрокаудальный приток посткардинальной вены [8]. Вслед за протоком и веществом мезонефроса протоковая вена поворачивает вентромедиально. От ее изгиба отходят ветви, вентральные – к метанефрогенной бластеме, дорсальные – к сомитам и несегментированной мезодерме. Межсегментарные сосуды вместе с рыхлой мезенхимой внедряются в толщу тяжа дорсальной мезодермы, в промежутки между еще только намечающимися сомитами.
Изложенное позволяет предположить, что в пространственно-временном аспекте сомитообразование сопряжено с кручением «мягкого» тела эмбриона в процессе его интенсивного каудального удлинения. Кручение является особым видом сдвига, приводящему к смещению слоев в неупругих телах вплоть до «течения» материала, как в жидкостях. Рыхлая мезенхима пластична, очень легко деформируется с усилением циркуляции межклеточной жидкости. Все это должно стимулировать рост протокапилляров, лишенных базальной мембраны. Кручение тела эмбриона сопровождается сходной деформацией продольных тяжей дорсальной мезодермы. На ее протяжении возникают участки сужения, где определяются выступы рыхлой мезенхимы с кровеносными микрососудами. Их стенки испытывают повышенное наружное давление (касательное напряжение кручения ?), что индуцирует их уплотнение и утолщение, начиная с эндотелия, – развитие его базальной мембраны и адвентициальной оболочки. Резистентность сосуду придает и кровяное давление (жидкость несжимаема). В результате возникает клин растущей жесткости, который: 1) «отсекает» от тяжа дорсальной мезодермы сомит; 2) фиксирует тяж мезодермы в этом месте, что приводит к каудальному распространению волны кручения и сегментирования дорсальной мезодермы. Такое (ступенчатое, пошаговое) ее взаимодействие с кровеносными сосудами, когда последние внедряются в мезодермальный тяж, «нарезая» сомиты, можно сравнить с зубчатой передачей, а с учетом кручения – с винтообразной передачей. Размер ее «шага» (→ сомита), т.е. сегментирования мезодермы, определяют, очевидно, мезодермальные клетки: тип (способ их группировки) и пределы (объем сомита) их роста адекватны свойствам их белков, информация о первичной структуре которых записана в геноме клеток. Сосудисто-мезенхимные перегородки аксиальной мезодермы растут между формирующимися розетками, т.е. в «слабые» места дифференцирующегося тяжа мезодермы – места снижающегося аффинитета ее клеток. Хотя в этих же участках определяются «перехваты» тела эмбриона, обусловленные кручением – генетическая детерминация и эпигенетическая регуляция процесса ?
Заключение
Кровеносные сосуды участвуют в морфогенезе сомитов как (раз)делители их зачатков в условиях продольного растяжения и кручения тела эмбриона с его мягким скелетом. Предлагаемая двухволновая модель сегментирования осевой мезодермы подкрепляет мое же предположение [10] о важной роли аорты в становлении квазисегментарного устройства тела человека, начиная с его эмбрионального периода развития. Волны дифференциации осевой мезодермы: 1) детерминации (или распространения компетентности [2]) – продольное растяжение мезодермы при удлинении эмбриона с напряжением адгезии клеток индуцирует их пролиферацию и сгущение, что стимулирует рост микрососудов; 2) регуляции процесса (как в виртуальной модели периодического морфогенеза E.С.Zeeman [2]) – кручение обусловливает поперечную перетяжку мезодермы, что облегчает ее разделение на сомиты сосудисто-мезенхимными клиньями. Причем вторая волна дифференциации (~ кручение) инициируется ее первой волной (удлинение тела эмбриона → краниокаудальный градиент напряжения мезодермы). Моя гипотеза корреллирует с разными предположениями о механике становлении метамерии животного в эволюции: 1) А.Ланга – связь с локомоцией и размещением сосудов; 2) Б. Гатчека и Э. Перрье – способность пролиферировать на заднем конце тела однородные небольшие участки [14].

