Заболеваемость туберкулезом, несмотря на широту осуществляемых лечебных и профилактических мероприятий, растет, причем увеличивается число случаев лекарственно-устойчивого туберкулеза [1]. Номенклатура средств антимикробной терапии огромна (более 200 антибиотиков) и постоянно увеличивается за счет внедрения в клиническую практику новых поколений антибиотиков, новейших антибактериальных препаратов, полученных путем химического синтеза [3]. В то же время недостаточно работ, посвященных изучению зависимости вида специфического действия от структуры соединений и нет обоснованных рекомендаций по целенаправленному синтезу. В связи с этим представляет интерес поиск новых противотуберкулезных средств, из числа ранее не использованных классов соединений среди продуктов органического синтеза.
Перспективным в данном направлении является исследование синтетических аналогов кумаринов, которые хорошо известны в плане ряда их фармакологической активности, обусловленной наличием в их структуре гетарильных фрагментов, чувствительных к изменению условий внешней среды. Одним из привлекательных свойств производных кумаринов является возможность синтеза соединений с заданными свойствами, способствующих изменению радикалов и незамещенных гетарильных фрагментов.
Целью настоящей работы явилась оценка антимикобактериальную активность синтезированных нами аналогов 3-гетероарил-4Н-кумаринов.
Материалы и методы исследования
Соединения (I) – (XII) синтезировали в условиях реакции Кневенагеля [6]. Первичный скрининг антимикобактериальной активности проводился in vitro. для анализа минимальной ингибирующей концентрации использовали образцы в концентрации 6,25 мкг/мл против Micobacterium tuberculosis H37Rv (ATTCC 27294) и Micobacterium tuberculosis Erdman (ТМСС 107) на среде BACTEC 12B, используя микроплаcтины Alamar Blue Assay (MABA). Флуоресценцию составов определяли на радиометрической системе BACTEC 460 [5], эффективность ингибирования выражали в %. Активными антимикобактериальными соединениями считали образцы, проявляющие активность сопоставимую с изониазидом (при концентрации 6,25 мкг/мл активность изониазида 90 %) [9].
Противотуберкулезная активность производных кумаринов и ряд
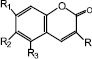
3-гетероарил-4Н-кумаринов против M. Tuberculosis H37Rv и M. Tuberculosis Erdman в BACTEC 12B (in vitro)
|
Наименование соединения |
R |
R1 |
R2 |
R3 |
Минимальная ингибирующая концентрация, мкг/мл |
Ингибирование, % |
|
|
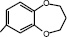
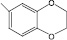
(I) – 3-(7-бензодиоксе-пан-1,5-ил)-4Н-кумарин |
|
Н |
Н |
Н |
>6,25 |
86 |
|
|
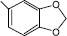
(II) – 3-(5-бензодиоксол-1,3-ил)-4Н-кумарин |
|
Н |
Н |
Н |
>6,25 |
76 |
|
|
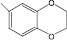
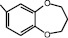
(III) – 3-(6-бензодиок-сан-1,4-ил)-4Н-кумарин |
|
Н |
Н |
Н |
>6,25 |
49 |
|
|
(IV) – 6-бромкумарин |
Н |
Н |
Br |
Н |
>6,25 |
39 |
|
|
(V) – 6-нитрокумарин |
Н |
Н |
NO2 |
Н |
>6,25 |
37 |
|
|
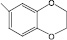
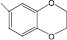
(VI) – 3-(6-бензодиок-сан-1,4-ил)-4Н-7-меток-сикумарин |
|
OCH3 |
Н |
Н |
>6,25 |
36 |
|
|
(VII) – 6-хлоркумарин |
Н |
Н |
Cl |
Н |
>6,25 |
30 |
|
|
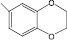
(VIII) – 3-(6-бензодиок-сан-1,4-ил)-4Н-5,6-нафтокумарин |
|
H |
-CH=CH-CH=CH- |
>6,25 |
30 |
||
|
(IX) – 3-(7-бензодиок-сепан-1,5-ил)-4Н-6-бромкумарин |
|
Н |
Br |
Н |
>6,25 |
29 |
|
|
(X) – 3-(6-бензодиоксан-1,4-ил)-4Н-6-нитроку-марин |
|
Н |
NO2 |
Н |
>6,25 |
24 |
|
|
(XI) – 5,6-нафтокумарин |
H |
H |
-CH=CH-CH=CH- |
>6,25 |
21 |
||
|
(XII) – 3-(6-бензодиок-сан-1,4-ил)-4Н-6-бром-кумарин |
|
Н |
Br |
Н |
>6,25 |
13 |
|
|
контроль Изониазид |
|
>6,25 |
90 |
||||
Результаты исследования и их обсуждение
В настоящей работе представлены результаты первичного скрининга на антимикобактериальную активность среди продуктов органического синтеза (I) – (XII). на антимикобактериальную активность были протестированы синтезированные нами ранее модифицированными методами [4, 6, 7] новые производные кумаринов, не содержащие гетарильных фрагментов (IV), (V), (VII), (XI), а также ряд 3-гетероарил-4Н-кумаринов, содержащих в составе фрагменты 1,3-бензодиоксола (II), 1,4-бензодиоксана (III), (VI), (VIII), (X), (XII) и 1,5-бензодиоксепана (I), (IX) (таблица).
Полученные кумарины (I) – (XII) – бесцветные кристаллические вещества, хорошо растворимые в большинстве органических растворителей и нерастворимые в воде. Они легко обнаруживаются по голубой или фиолетовой флуоресценции в УФ-свете [6]. Структуры впервые полученных кумаринов были доказаны с помощью элементного анализа, спектров 1Н-ЯМР и масс-спектрометрического анализа [2, 6].
Исследование антимикобактериальной активности образцов проводилось совместно с Southern Research Institute, Birmingham в рамках Антитуберкулезной программы «Tuberculosis Antimicrobial Acquisition & Coordinating Facility», USA в сравнении с изониазидом как стандартом (эффективная доза 6,25 мкг/мл) [8, 10].
Антимикобактериальная активность кумаринов, полученных на основе ряда ароматических альдегидов, зависела от радикалов и незамещенных гетарильных фрагментов. Так, из ряда 3-гетероарил-4Н-кумаринов соединение (I) с 1,5-бензодиоксепановым фрагментом ингибировало рост микобактерий на 86 %, тогда как его бромзамещенный кумарин (IX) практически не обладал таким свойством, ингибируя рост микобактерий лишь на 29 %. Незамещенный кумарин (II) с 1,3-бензодиоксоловым фрагментом ингибировал рост микобактерий на 76 %, а соединение (III) с 1,4-бензодиоксановым фрагментом только на 49 %. Замещенные соединения (VI), (VIII), (X), (XII) с 1,4-бензодиоксановым фрагментом обладали низкой активностью (от 13 до 36 %). Введение различных заместителей кумаринов (IV), (V), (VII), (XI) не приводило к увеличению активности в отношении микобактерий туберкулеза. Так, при этом она менялась от 21 до 39 %.
Следует отметить, что незамещенный кумарин (I) с 1,5-бензодиоксепановым фрагментом был более активен, чем с 1,3-бензодиоксоловым (II) и 1,4-бензодиоксановым (III) фрагментами. Мы полагаем, что в проявлении антимикобактериальной активности имеет значение взаимодействие гетарильного фрагмента 1,5-бензодиоксепана с мембраной M. Tuberculosis. Замещенные кумарины бензольного кольца (-Br, -NO2, -OCH3, -Cl, -CH=CH-CH=CH-) (IV) – (XII) оказались не активными.
Как видно из полученных результатов, наличие в структуре синтетических аналогов кумаринов незамещенного гетарильного фрагмента способствует развитию антимикобактериальной активности, когда процент торможения роста микобактерий составляет 80-86 %. Именно эти соединения могут быть модифицированы до достижения антимикобактериальной активности до 90 % и более, они являются перспективными в плане синтеза на их основе противотуберкулезных препаратов.
Таким образом, изучение биологической активности синтетических аналогов кумаринов показало перспективность исследования их антимикобактериальных свойств. Наличие в структуре синтетических аналогов кумаринов незамещенного гетарильного фрагмента способствует развитию антимикобактериальной активности. Изменение природы заместителей в структуре кумаринов не приводит к повышению их антимикобактериальной активности.