В 50–60-х годах была разработана и получила широкое применение технология сорбционного извлечения урана при переработке рудного сырья в гидрометаллургических урановых производствах. Данный технологический процесс отличается высокой производительностью, селективным извлечением урана на смоле. Технология сорбционного извлечения урана предусматривает замкнутую схему водооборота, исключающую сбросы в открытую гидрографическую сеть [1].
В гидрометаллургии урана применяется кислотное или карбонатное выщелачивание урана из рудного сырья.
Достаточно подробно процесс сорбционного извлечения урана из кислых растворов со стадии выщелачивания рудного сырья описан Матвеевым Ю.Н. и Стрижко В.С. [2]. В урановой промышленности применение ионообменной технологии на базе ионитов обусловлено тем, что уран в растворах после выщелачивания находится в виде различных комплексных анионитов уранила [UO2(SO4)2]2–, [UO2(SO4)3]4– (в сернокислой среде) и [UO2(СO3)3]4– (в карбонатной). В этом случае процесс сорбции описывается уравнениями:
4[R4N]+Cl– + [UO2(SO4)3]4– 
 [R4N]4[UO2(SO4)3] + 4Cl–; (1)
[R4N]4[UO2(SO4)3] + 4Cl–; (1)
2[R4N]+Cl– + UO2(SO4)3]2– 
 [R4N]4[UO2(SO4)3] + 2Cl–. (2)
[R4N]4[UO2(SO4)3] + 2Cl–. (2)
Одновременно, хотя и в меньшей степени, протекают конкурирующие процессы сорбции других присутствующих в растворе анионов SO42–, HSO4–, Fe(SO4)2–, Fe(SO4)33–, некоторые анионы форм V, P, As, Mo, а также Cl– и NO3–. Катионы Fe2+, Ca2+, Mg2+, Na+, K+, Cu2+, Co2+, Ni2+ и некоторые другие не сорбируются.
При высокой кислотности особенно проявляется конкурирующая сорбция HSO4–, заметно снижающая ёмкость смолы по урану. Поэтому сорбция урана интенсивнее протекает при высоких значениях рН.
При снижении кислотности и повышении концентрации урана в растворе ёмкость смолы растёт, т.к. вместо четырёхзарядных анионов [UO2(SO4)4]4– сорбируются преимущественно двухзарядные комплексы [UO2(SO4)2]2–. При дальнейшем снижении кислотности (рН 2,5) ёмкость смолы увеличивается вследствие гидролитического образования комплексов урана типа: [U2O5(SO4)3]4– и [U2O5(SO4)2]2– (рис. 1).
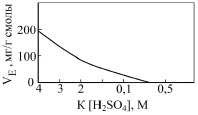
Рис. 1. Влияние кислотности К на сорбционную ёмкость VE (по урану) сильноосновного анионита [2]
Ёмкость смол существенно зависит от присутствия некоторых солей (рис. 2). Депрессирующее действие некоторых солей используют на стадии снятия урана со смол (десорбции, регенерации). Десорбция является обратным процессом по отношению к сорбции. Поэтому для десорбции в урановой промышленности обычно применяют азотную, соляную, крепкую серную кислоту, хлоридные или нитритные растворы.
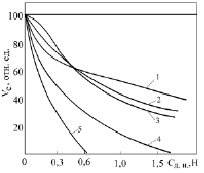
Рис. 2. Зависимость сорбционной ёмкости Ve по уран сильноосновного анионита от концентрации Сд.и депрессирующих ионов [2]: 1 – PO43–; 2 – NO3–; 3 – F–; 4 – SO42–; 5 – Cl–
Важно отметить, что при десорбции требуется не только выделить уран из фазы смолы в раствор, но и сконцентрировать его в максимально малом объёме. В производственной практике, как правило, объём растворов после десорбции значительно меньше объёма исходных растворов, что позволяет эффективно сконцентрировать уран в регенерате, из которого уран обычно осаждают аммиаком, NaOH или MgO. После отделения фильтрацией осадка диураната десорбирующий раствор, подкислив, используют для повторной регенерации.
В настоящее время в урановой промышленности для сорбционной технологии используют аппараты с неподвижным слоем смолы для осветлённых растворов и аппараты с подвижным слоем смолы для извлечения урана из пульпы.
В своё время сорбцию урана из растворов в аппаратах с фиксированным слоем смолы широко применяли на заводах в ЮАР, где перерабатывали хвосты 27 золотоизвлекающих фабрик. Эти заводы использовали схему (рис. 3), типичную для сорбции урана из осветлённых растворов, по которой сорбцию урана осуществляли в колоннах с фиксированным слоем смолы, выполненных из стали и затем гуммированных, высотой 3,65 и диаметром 2,13 м. Скорость пропускания растворов при сорбции достигала 300 л/мин.
При такой схеме достигается комплексный расход сырья. Тем не менее, из-за серьёзных недостатков таких схем в настоящее время их считают устаревшими. Основными недостатками их считают большие капитальные затраты на сложное кислотоупорное оборудование (не менее 25 % всех капитальных затрат); большие эксплуатационные расходы в цикле фильтрации (около 20 % стоимости всего передела); повышенные потери урана в результате неполного отделения растворов и удерживания урана кеком на стадии фильтрации. Поэтому в настоящее время урановые заводы переходят на схемы, предусматривающие извлечение урана сорбцией непосредственно из пульп.
Особое место среди методов извлечения урана сорбцией из пульп является способ сорбционного выщелачивания, разработанный в СССР. В основу этого метода положен принцип совмещения процесса выщелачивания и сорбции. Введение в пульпу ионита непосредственно в процесс выщелачивания сопровождается дополнительным извлечением урана в целевые продукты. Дополнительное извлечение урана при этом достигается не только вследствие смещения равновесия между твёрдой фазой и раствором и снятием диффузионных ограничений скорости выщелачивания, но и сведением к минимуму воздействий таких факторов, как обратное осаждение и соосаждение, окклюзия и сорбция урана рудным остатком. Всё это позволяет проводить выщелачивание при меньших концентрациях растворителя, иметь более высокую сорбционную ёмкость ионита и интенсифицировать процесс совмещением операций выщелачивания и сорбции, а также исключить цикл фильтрации. Эффект повышения извлечения урана в присутствии анионита ЭДЭ-10П показан на рис. 4.
В промышленности сорбционное выщелачивание проводят в пачуках с использованием технологической схемы непрерывного сорбционно-десорбционного цикла переработки пульпы в пачуках. Эта схема универсальна и пригодна для переработки пульп с содержанием твёрдого до 50–60 % масс., в том числе 3–5 % масс. частиц крупностью +0,15 мм. Объём сорбционных аппаратов в таких схемах достигает нескольких сотен кубометров. Большая производительность аппаратов позволяет сократить до минимума количество технологических веток. В аппаратах нет движущихся частей и конструкций, процесс легко поддаётся автоматизации, устойчив. Транспортирование ионита осуществляется достаточно просто и сводит потери к минимуму.
Составы исходного раствора перед сорбцией и получаемого химического концентрата по этой схеме приводятся в табл. 1.
Тураев Н.С. и Жерин И.И. [3] приводят следующее описание сорбционной технологии извлечения урана в гидрометаллургических урановых производствах при переработке кислых растворов со стадии выщелачивания рудного сырья.
Рис. 3. Технологическая схема извлечения урана на заводах ЮАР [2]
Таблица 1
Составы исходного раствора перед сорбцией и получаемого химического концентрата [2]
|
Продукт технологии |
Содержание компонентов, г/л (% масс.) |
|||||||
|
U3O8 |
SO42– |
Fe2O3 |
MnO |
Al2O3 |
SiO2 |
MgO |
CaO |
|
|
Исходный раствор |
0,26 |
42,50 |
6,01 |
11,61 |
1,50 |
1,10 |
3,60 |
0,58 |
|
Концентрат |
(94,60) |
(0,39) |
(1,86) |
(0,18) |
(1,86) |
(1,92) |
(0,15) |
(1,56) |
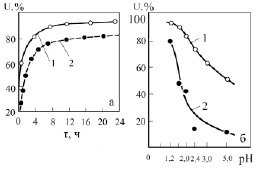
Рис. 4. Зависимость эффекта сорбционного выщелачивания (извлечения урана) от продолжительности τ выщелачивания (а) и рН среды (б) [2]: 1 – с анионитом ЭДЭ-10П; 2 – без анионита
Как было отмечено выше, уран в сернокислых растворах может находиться в виде катиона уранила, недиссоциированной молекулы уранилсульфата и в виде сульфатных комплексов анионов, соотношение между которыми зависит от концентрации сульфат-ионов и ионов уранила в соответствии с реакциями:
UO22+ + SO42–  UO2SO4, K1 = 50; (3)
UO2SO4, K1 = 50; (3)
UO22+ + 2SO42–  [UO2(SO4)2]2–, K2 = 350; (4)
[UO2(SO4)2]2–, K2 = 350; (4)
UO22+ + 3SO42–  [UO2(SO4)3]4–, K3 = 2500. (5)
[UO2(SO4)3]4–, K3 = 2500. (5)
Можно считать, что в растворе существует подвижное равновесие:
UO22+ + SO42– 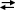 UO2SO4 + SO42–
UO2SO4 + SO42– 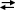
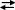 [UO2SO4]2– + SO42–
[UO2SO4]2– + SO42– 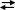 [UO2(SO4)3]4–. (6)
[UO2(SO4)3]4–. (6)
Следовательно, для извлечения урана можно применить и катиониты, которые будут извлекать катион уранила, и аниониты, которые будут извлекать анионные комплексы, главным образом, [UO2(SO4)3]4–.
По мере удаления ионов UO22+ или [UO2(SO4)3]4– из растворов в ионит будет наблюдаться сдвиг равновесия в растворе в сторону извлекаемого иона.
Сильнокислотные катиониты (например, КУ-2) не могут быть применены для извлечения урана из растворов после выщелачивания. При увеличении концентрации сульфат-иона до 10–15 г/л ёмкость резко уменьшается (вплоть до 0). Это связано с тем, что по мере увеличения концентрации сульфат-иона рассмотренное подвижное равновесие сдвигается в сторону образования сульфатных анионных комплексов, и коэффициент активности катиона уранила во внешнем растворе уменьшается.
В этих условиях может работать слабокислотный катионит СГ-1. В данном случае уменьшение коэффициента активности иона уранила в растворе компенсируется уменьшением коэффициента активности иона уранила в фазе ионита. Известно, что растворимость солей уранила и карбоновых кислот мала (например, UO2C2O4 – оксалат уранила).
Процесс извлечения урана смолой СГ-1 описывается уравнением:
2R–COOH + UO22+  UO2(RCOO)2 + 2H+. (7)
UO2(RCOO)2 + 2H+. (7)
В соответствии с этим уравнением повышение кислотности сдвигает равновесие влево, поэтому при малых значениях рН (< 1) ёмкость по урану равна 0. При увеличении рН выше 1,2 ёмкость начинает расти и достигает максимума при рН = 3,5, затем несколько уменьшается (рис. 5).
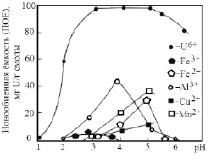
Рис. 5. Влияние рН на ёмкость смолы СГ-1 по урану и примесям, концентрация урана в растворе 1 г/л [3]
Рабочей областью считается рН = 2,8–3,5 – при меньших значениях рН уменьшается ёмкость, при больших значениях рН нужно учитывать возможность осаждения урана вследствие гидролиза (гидролиз сульфата уранила начинается при рН = 3,8).
Так как в процессе ионного обмена выделяется кислота (Н+) и рН уменьшается, то во время сорбции для поддержания заданного значения рН производится добавление щелочных реагентов: NH4OH, NaOH или известкового молока. Двузарядные катионы примесей (Fe2+ и Mn2+) не могут конкурировать с уранилом (его преимущество – меньший размер гидратной оболочки и малый коэффициент активности в ионите). При рН = 3 ёмкость по иону Mn2+ при концентрации его в растворе 5 г/л составляет 4 мг/г или 0,14 мг-экв/г, ёмкость по Fe2+ (концентрация в растворе 2 г/л) – 2 мг/г или 0,07 мг-экв/г. По тем же причинам двухзарядный катион уранила сорбируется смолой СГ-1 лучше, чем трёхзарядный катион алюминия. Ёмкость по Al3+ (при концентрации в растворе 2 г/л) составляет 20 мг/г или 2,2 мг-экв/г. Ёмкость по урану 100 мг/г или 0,8 мг-экв/г, что в 2,6 раза меньше, чем Al3+. Но концентрация алюминия в растворе 2 г/л, или 0,22 мг-экв/г, в то время как концентрация урана 1 г/л, или ~0,01 мг-экв/г, т.е. в 20 раз меньше, чем у Al3+.
С уранилом мог бы конкурировать ион Fe3+. Но, учитывая, что гидролиз сульфата железа (III) начинается при рН = 2,5, при рН = 2,8–3,5 концентрация Fe3+ в растворе составляет 50–10 мг/л и ёмкость по Fe3+ – 4 мг/г, или 0,26 мг-экв/г (при рН = 3). Смола СГ-1 селективна по отношению к иону водорода: так при полной ёмкости 8,9 мг-экв/г после вычета суммы ёмкостей по отношению к UO22+, Fe3+, Al3+, Mn2+, Fe2+ и других катионов на долю Н+ остаётся порядка 5 мг-экв/г, в то время как при рН=3 концентрация Н+ во внешнем растворе составляет 0,001 мг-экв/г, т.е. в 10 раз меньше, чем концентрация UO22+.
Наличие комплексообразующих ионов (F–, C2O42–, PO43–) может привести к снижению ёмкости СГ-1 по урану, т.к. уменьшается активность иона уранила. Присутствие нитрат-иона не влияет на ёмкость по урану. После насыщения смолы и отделения её от раствора (пульпы) производится регенерация смолы (десорбция).
Из рис. 5 следует, что регенерацию можно провести любой кислотой при рН < 1. Поэтому для регенерации используется 2–5 % раствор серной, азотной или соляной кислоты, причём с увеличением концентрации кислоты уменьшается объём товарного регенерата. При регенерации примерно 90 % урана извлекается в объём регенерата, соответствующий объёму смолы, а окончание регенерации наблюдается при пропускании через смолу 4–5 объёмов регенерирующего раствора (элюата). При удельном объёме набухшей смолы СГ-1 2,0–2,5 мл/г объёмная ёмкость составит 40–50 г урана на литр смолы, значит, при объёме регенерата 4 л концентрация урана в нём составит 10–12 г/л.
Таким образом, при проведении цикла сорбция-десорбция происходит концентрирование урана в десятки раз и освобождение от большей части примесей. В солевой части товарного регенерата содержание урана составляет 50–70 % (в пересчёте на U3O8).
Как было указано, в сернокислом растворе существует подвижное равновесие между различными формами урана от катиона уранила до четырёхзарядного сульфатного анионного комплекса. Соотношение между этими комплексами зависит от концентрации сульфат-иона, кислотности. При рН < 1 уран почти полностью находится в виде комплексного аниона [UO2(SO4)3]4–.
В этом случае сорбция идёт следующим образом:
4(R4N)Cl + [UO2(SO4)3]4– 
 (R4N4)[UO2(SO4)3] + 4Cl–. (8)
(R4N4)[UO2(SO4)3] + 4Cl–. (8)
При высокой кислотности вместе с ураном сорбируются и ионы бисульфата (НSO4–), обладающие довольно большим сродством к сильноосновным смолам. В силу этого при повышении кислотности ёмкость анионитов по отношению к урану уменьшается; особенно резко это сказывается у сильноосновных смол.
При увеличении рН в пределах 1,5–5 концентрация анионных недиссоциированных молекул уранилсульфата и катиона уранила. Наиболее вероятный механизм сорбции урана можно представить следующим образом: вначале происходит переход смолы от хлоридной или нитратной формы в сульфатную форму, а затем к ней присоединяются молекула уранилсульфата или ионы уранила и сульфата:
4(R4N)Cl + SO42–  (R4N)2SO4 + 2Cl–, (9)
(R4N)2SO4 + 2Cl–, (9)
2(R4N)2SO4 + UO22+ + SO42– 
 (R4N)4[UO2(SO4)3]. (10)
(R4N)4[UO2(SO4)3]. (10)
При сложении реакций (9) и (10) получим:
4(R4N)Cl + UO22+ + 3SO42– 
 (R4N)4[UO2(SO4)3] + 4Cl–ю (11)
(R4N)4[UO2(SO4)3] + 4Cl–ю (11)
При рН > 2,5 общее поглощение урана на сильноосновных смолах (полная ёмкость 3–3,5 мг-экв/г) может быть выше, чем это соответствует полному насыщению смолы анионами [UO2(SO4)3]4– и НSO4–. По всей вероятности, это обусловлено частичным гидролизом иона уранила:
2UO22+ + OH–  U2O52+ + H2O (12)
U2O52+ + H2O (12)
и сорбцией на смоле на ряду с [UO2(SO4)3]4– и иона [U2O5(SO4)3]4–.
Поскольку среда кислая (рН < 4), то в ней могут работать аниониты любой основности, даже слабоосновные и очень слабоосновные.
Аниониты проявляют большую селективность по отношению к урану, чем катиониты. Это связано с двумя обстоятельствами. Во-первых, аниониты сорбируют уран в виде четырёхзарядного анионного комплекса, в то время как заряд катиона уранила (+2). Во-вторых, большая часть примесей находится в катионной форме, не давая анионных комплексов и, следовательно, не участвуя в обмене.
Вместе с ураном могут сорбироваться молибден в виде сульфатного анионного комплекса [MoO2(SO4)3]–, а также в небольших количествах железо в виде [Fe(SO4)2]–, [Fe(SO4)3]3–, [Fе(OH)(SO4)2]2–, фосфат-ион, ванадат-ион. Присутствие молибдена, ванадата, фосфата, цианида снижает ёмкость по урану.
После насыщения смолы производится её регенерация (десорбция). Регенерация смолы производится путём вытеснения анионных комплексов ионами Cl– или NO3– при повышении их концентрации. В качестве вымывающих растворов используют 1 М NaCl, подкисленный 0,1 HCl, или 1 М NH4NO3, подкисленный 0,1 М HNO3 или 0,15 М H2SO4.
Если регенерацию проводить в динамических условиях, пропуская регенерирующий раствор через неподвижный слой насыщенного ионита, то кривая вымывания имеет вид, показанный на рис. 6.
Первый и второй объёмы содержат несколько процентов урана и основное количество железа, эти объёмы можно возвратить на сорбцию. Третий, четвёртый и пятый объёмы содержат основное количество урана – это товарный регенерат с высокой концентрацией урана. Шестой, седьмой и восьмой объёмы с небольшим содержанием урана можно использовать на приготовление регенерирующего раствора. Если же десорбция проводится в противоточном каскаде, то концентрация урана в товарном регенерате усредняется, то есть можно получить товарный регенерат с концентрацией урана 10–20 г/л. Из таких растворов путём щелочного осаждения можно получить концентрат урана с содержанием 70–90 % U3O8, фильтраты можно повторно использовать для приготовления десорбирующего раствора.
Один из вариантов организации технологического процесса сорбции–десорбции приведён на рис. 7.
При длительной работе ионита наблюдается некоторое уменьшение ёмкости смолы за счёт постепенного накопления примесей, не снимаемых со смолы растворами солей и кислот. Наступает «отравление» смолы. Поэтому смолу периодически обрабатывают специальными растворами для удаления таких примесей.
Ряд авторов [3–6] приводят сорбционную технологию извлечения урана из растворов, получаемых при карбонатном выщелачивании рудного сырья в гидрометаллургических урановых производствах.
После карбонатного выщелачивания уран находится в растворе в виде комплексного аниона [UO2(CO3)3]4–. Поскольку константа стойкости этого аниона 2∙1018, т. е. на 15 порядков больше, чем константа стойкости сульфатных анионных комплексов, то равновесия между катионом UO22+ и анионом [UO2(CO3)3]4– нет, ввиду того, что катион UO22+ практически отсутствует. Поэтому для извлечения урана из карбонатных растворов можно использовать только аниониты. Выбор анионитов ограничен в связи с тем, что среда щелочная. Можно использовать только сильноосновные аниониты, работающие при всех значениях рН.
В США использовали для извлечения урана из карбонатных растворов сильноосновный анионит IRA-400 (аналог этой смолы – AM).
В связи с большим зарядом карбонатного комплексного аниона процесс извлечения урана идет селективно:
4R4NCl + [UO2(CO3)3]4– 
 (R4N)4[UO2(CO3)3] + 4Cl–. (13)
(R4N)4[UO2(CO3)3] + 4Cl–. (13)
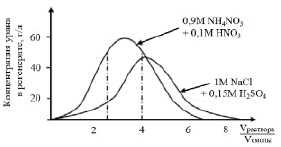
Рис. 6. Зависимость концентрации урана в товарном регенерате от соотношения объёмов регенерата и смолы [3]
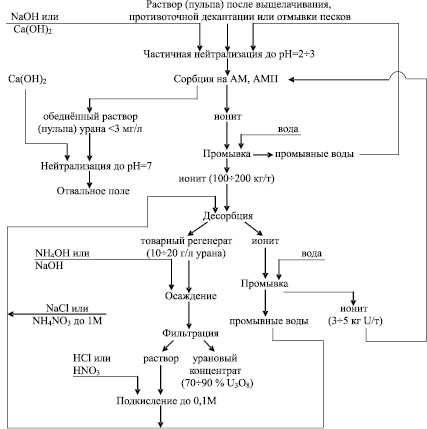
Рис. 7. Технологическая схема анионообменного извлечения урана из сернокислых растворов (пульп) [3]
Таблица 2
Зависимость ёмкости по урану анионита IRА-400 от концентрации соды [3]
|
Концентрация Na2CO3, г/л |
1 |
5 |
10 |
30 |
50 |
100 |
|
Ёмкость по урану, мг U3O8/г |
274 |
200 |
191 |
163 |
130 |
100 |
Однозарядный анион алюмината практически не сорбируется. При избытке соды практически не сорбируются ванадат-ион и фосфат-ион. Ёмкость смолы по урану падает с увеличением избыточной концентрации соды в исходном растворе, что объясняется конкуренцией карбонат-иона:
2R4NCl + CO32–  (R4N)2CO3 + 2Cl–. (14)
(R4N)2CO3 + 2Cl–. (14)
Снижение ёмкости смолы IRA-400 (полная ёмкость 3,33 мг-экв/г) от повышения концентрации соды при исходной концентрации раствора 0,5 г/л по U3O8 можно проиллюстрировать табл. 2.
При остаточной карбонатности 20–40 г/л ёмкость по урану составляет 175–140 мг U3O8/г, что несколько больше, чем для сильноосновных смол при извлечении урана из сернокислых растворов. Присутствие соды хотя несколько снижает ёмкость по урану, но зато способствует вытеснению из смолы ваннадат- и фосфат-ионов. Обеднённый раствор после сорбции урана можно повторно использовать для карбонатного выщелачивания. Десорбция урана производится 2М раствором NaCl или NaNO3, содержащим 5 г/л Na2CO3. Концентрация урана в товарном регенерате составляет ~25 г/л, что примерно в 50 раз больше, чем в исходном растворе. Из товарного регенерата путём химического осаждения можно получить концентрат, содержащий более 90 % U3O8.
Следует отметить, что растворы, получаемые при регенерации анионитов по кислотной и карбонатной линиям, по содержанию урана и примесей близки друг к другу. Тем самым нивелируется такое преимущество карбонатного выщелачивания, как его селективность. Поэтому кислотное выщелачивание имеет более широкое распространение, чем карбонатное. Кислотное выщелачивание применяется для вскрытия всех руд, кроме высококарбонатных, кислотное выщелачивание которых требует слишком большого расхода серной кислоты.
На большинстве американских и канадских заводов после карбонатного выщелачивания уран осаждался едким натром [3, 6]. Ионнообменное извлечение урана из карбонатных растворов в контейнерных аппаратах использовалось на заводе «Монтиселло», остановленном в1960 г., а также на заводе «Моаб» до1975 г. В процессе реконструкции завода отказались от сорбции из карбонатных пульп и перешли на прямое осаждение урана сначала едким натром, а на втором этапе безводным аммиаком с добавлением пероксида водорода.
В Казахстане урановое гидрометаллургическое производство действует в г. Степногорске [5] на горно-металлургическом заводе ТОО «Степногорский горно-химический комбинат», где применяют автоклавное выщелачивание урана из рудного сырья карбонатными растворами. В указанном производстве для сорбционного извлечения урана из получаемых со стадии выщелачивания карбонатных растворов применяют сорбенты производства России, а именно Россион-5, Россион-12 и АМ-2Б. Также на данном предприятии ведётся работа по поиску более эффективных сорбентов. В результате технологического опробования ряда новых эффективных органических сорбентов (смол) на Степногорском горно-химическом комбинате рекомендован для использования в технологии иониты марки Purolite. При концентрации урана в растворе со стадии выщелачивания сырья 1,4 г/л, достигается извлечение урана в сорбент 98 %. Сорбционная ёмкость анионита А-600 (Purolite) по урану составила 60 г/кг смолы, что в 1,5–2,0 раза выше, чем у используемых на данном горно-металлургическом заводе российских сорбентов.

