Заболевания печени, такие как хронический алкогольный гепатит, хронический гепатит вирусной этиологии, цирроз печени, аутоиммунная патология печени, получили широкое распространение среди населения Российской Федерации. Это обусловлено низкой эффективностью современных методов лечения хронических гепатитов, а также малой изученностью молекулярных механизмов этих заболеваний, что затрудняет проведение патогенетической терапии.
В патогенезе хронического гепатита имеет значение гибель гепатоцитов и непаренхимальных клеток печени. Программированная гибель клеток, или апоптоз, может реализоваться несколькими различными механизмами, что определяется состоянием клетки на момент проведения сигнала гибели. Все типы апоптоза можно условно разделить на рецептор-зависимые, митохондриально-зависимые и стресс-индуцированные.
Известно, что на гепатоцитах экспрессируется, в основном, первый рецептор фактора некроза опухолей – TNF-R1, тогда как второй рецептор – TNF-R2, экспрессируется, главным образом, на нейтрофилах, натуральных киллерах и лимфоцитах и его экспрессия повышается при патологии печени. На гепатоцитах экспрессия TNF-R2 минимальна, но именно этот рецептор обусловливает проведение сигнала для массивной гибели паренхимальных клеток печени [9].
Согласно литературным данным, имеется прямая корреляция между процентом апоптозных клеток и степенью распространения лобулярных некрозов [7].
На восстанавливающихся после повреждения клетках печени повышена экспрессия маркеров апоптоза, в частности, белков Bax и Fas, при этом частота обнаружения апоптозных клеток коррелировала с экспрессией Bax и степенью инфильтративного воспаления. То есть, апоптоз играет ведущую роль в массивной гибели гепатоцитов при хроническом гепатите, а восстанавливаемые клетки печени несут повышенное число рецепторов апоптоза.
Эти данные позволяют утверждать, что одним из механизмов апоптоза в гепатоцитах является митохондриально-зависимый тип апоптоза. Для проверки этой гипотезы мы провели эксперименты с клетками биоптатов печени больных хроническим гепатитом с целью определения влияния ингибиторов митоходриального окисления на индуцированный апоптоз.
Используемые ингибиторы: динитрофенол (DNP), олигомицин и хлорцианокарбамил фосфат (СССР). Блокирование митохондриального окисления динитрофенолом снижало число клеток, вышедших в апоптоз под действием церамида. Одновременное добавление динитрофенола и СССР полностью блокировало как апоптоз, так и некроз в клетках печени.
На гепатоцитах экспрессируется также значительное количество Fas/Apo-1/CD95 рецепторов апоптоза. В связи с этим мы проанализировали уровень экспрессии рецепторов CD95/Fas/Apo-1, TNF-R1, TNF-R2 на выделенных клетках печени больных хроническим гепатитов.
Методически работа осуществлялась по следующей схеме. Биоптаты печени больных, сразу после их извлечения из иглы Мангини, переносили в полную среду RPMI 1640, куда добавляли 0,1 % коллагеназу I типа (Boehringer Mannhein, USA), 0,1 % трипсин (Sigma) и 5 % ЭТС и инкубировали в течение 20 минут при комнатной температуре при периодическом пипетировании. Полученная взвесь клеток осаждалась и затем отмывалась полной cредой RPMI 1640 с 5 % ЭТС. Подсчитывали концентрацию полученного суммарного пула клеток печени и доводили её до конечной концентрации 200х103 в мл. Отбирали по 50 мкл суспензии клеток и окрашивали моноклональными антителами к антигенам CD95, TNF-R1, TNF-R2. Число клеток, экспрессирующих рецепторы, измеряли на проточном цитометре. Примеры гистограмм, соответствующих экспрессии рецепторов TNF-R1 и TNF-R2 на клетках биоптатов печени больных хроническим гепатитом, представлены на рис. 1 и 2.
Было показано, что экспрессия рецепторов фактора некроза опухолей TNF-R1, -R2 возрастает по мере утяжеления клинической картины при хронических заболеваниях печени (табл. 1. и 2). Именно проведению сигналов апоптоза через рецепторы TNF-R1, -R2 отводится главная роль в гибели гепатоцитов [5,6]. В связи с этим дальнейшей задачей наших исследований было определение уровня апоптоза и некроза в нефракционированных клетках биоптата печени, а также механизма гибели клеток печени.
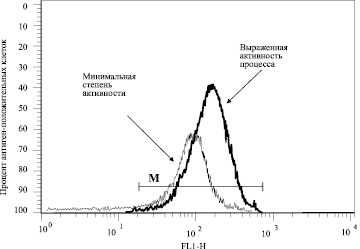
Рис. 1. Пример флюоресценции клеток, окрашенных моноклональными антителами к рецептору TNF-R1 в биоптате печени больных хроническим алкогольным гепатитом
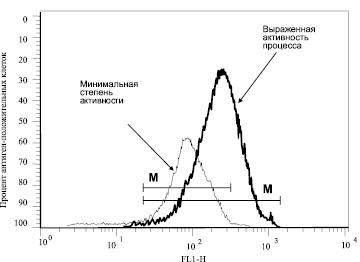
Рис. 2. Пример флюоресценции клеток, окрашенных моноклональными антителами к рецептору TNF-R2 в биоптате печени больных хроническим алкогольным гепатитом
Таблица 1
Уровень экспрессии рецепторов апоптоза на нефракционированных клетках биоптатов печени больных хроническими заболеваниями печени
|
Нозология |
Стадии* |
n= |
Процент антиген-положительных клеток |
||
|
% TNF-R1 |
% TNF-R2 |
% CD95/Fas |
|||
|
Хронический Алкогольный Гепатит |
I |
5 |
40 ± 2 |
45 ± 2 |
54 ± 4 |
|
II |
5 |
45 ± 2 |
52 ± 4 |
69 ± 8 |
|
|
III |
5 |
58 ± 3 |
75 ± 7 |
83 ± 7 |
|
|
Неспецифический Реактивный Гепатит |
I |
5 |
45 ± 2 |
45 ± 3 |
56 ± 3 |
|
II |
5 |
48 ± 3 |
53 ± 5 |
59 ± 5 |
|
|
III |
5 |
56 ± 5 |
61 ± 5 |
64 ± 5 |
|
|
Стеатоз |
I |
5 |
42 ± 2 |
45 ± 4 |
50 ± 2 |
|
II |
5 |
55 ± 7 |
58 ± 7 |
57 ± 3 |
|
|
III |
5 |
59 ± 7 |
64 ± 7 |
62 ± 4 |
|
|
Цирроз печени |
I |
7 |
48 ± 3 |
62 ± 5 |
72 ± 5 |
|
Всего больных n = 42 |
|||||
*Стадии заболевания определялись согласно модифицированному индексу гистологической активности. I стадия – некрозы отсутствуют, II стадия – единичные некрозные клетки, III стадия – единичные мостовидные некрозы.
Таблица 2
Уровень спонтанного апоптоза и некроза в нефракционированных клетках биоптатов печени больных хроническими заболеваниями печени
|
Нозология |
Стадии* |
n= |
Процент спонтанного апоптоза ( %) |
Процент спонтанного некроза ( %) |
|
Хронический алкогольный гепатит |
I |
5 |
12 ± 2 |
3 ± 1 |
|
II |
5 |
10 ± 2 |
8± 2 |
|
|
III |
5 |
8 ± 1 |
11 ± 1 |
|
|
Неспецифический реактивный гепатит |
I |
5 |
12± 2 |
4± 1 |
|
II |
5 |
11 ± 2 |
6 ± 1 |
|
|
III |
5 |
9± 1 |
9± 1 |
|
|
Стеатоз |
I |
5 |
11 ± 2 |
5± 1 |
|
II |
5 |
14± 3 |
11± 3 |
|
|
III |
5 |
16± 2 |
16 ± 2 |
|
|
Цирроз печени |
I |
7 |
14 ± 2 |
21± 2 |
|
Всего больных n = 42 |
*Стадии заболевания определялись согласно модифицированному индексу гистологической активности. I стадия – некрозы отсутствуют, II стадия – единичные некрозные клетки, III стадия – единичные мостовидные некрозы.
По данным литературы, уровень спонтанного апоптоза и некроза в печени может коррелировать с повышенной активностью АЛТ [1,5,6]. Повышение активности патологического процесса в печени сопровождается повышением числа гранзим-положительных клеток в портальной области. Внутри долек возрастает число клеток, экспрессирующих Fas-лиганд, к которым относятся некоторые минорные субпопуляции лимфоцитов и клетки Купфера [2,8]. Одновременно повышается цитотоксическая активность клеток иммунной системы. Всё это создает предпосылки для повышения уровня спонтанного апоптоза внутри долек печени.
В настоящее время принято считать, алкоголь не оказывает прямого цитопатического действия на ткани печени, то есть не вызывает выраженного некроза. Потребление алкоголя резко снижает спонтанную секрецию интерлейкина-1 и фактора некроза опухоли клетками печени. При этом соотношени субпопуляций клеток иммунной системы в печени долгое время остается стабильным. Однако эти клетки функционально изменены. Стимуляция митогенами, такими как конканавалин-А, резко повышает секрецию провоспалительных цитокинов и процент реактивных CD4+CD25+ Т-лимфоцитов. Выброс цитокинов приводит к выраженной воспалительной реакции в ткани печени [3, 4,5 ].
Выводы
Впервые выявлены изменения, касающиеся экспрессии рецепторов апоптоза на клетках периферической крови. Показано, что значительно повышается экспрессия рецепторов CD95, а также двух рецепторов фактора некроза опухолей альфа, то есть TNF-R1, TNF-R2, что является абсолютно приоритетным в данном направлении исследований.
Показано, что нарушения в изменении экспрессии рецепторов апоптоза сопровождаются повышением спонтанного и индуцированного апоптоза в клетках периферической крови больных хроническими заболеваниями печени.

