С развитием законов квантовой механики стало возможным объяснение порядка расположения электронов в атоме для каждого химического элемента. Одним из наиболее эффектных результатов, полученных с помощью квантовой теории, явилось в свое время теоретическое построение периодической системы элементов Менделеева, выполненное Нильсом Бором в 1922 году.
В основу построения периодической системы элементов положены три допущения:
- структура атомов определяется атомным номером Z (зарядом ядра). Изотопы данного элемента обладают одинаковой структурой.
- по мере возрастания атомного номера и увеличения числа электронов в атоме электроны заполняют состояния с наименьшей возможной энергией.
- заполнение энергетических состояний ограничено принципом Паули.
Здесь огромную роль сыграл принцип запрета предложенная Паули, как его называют принципом Паули.
Во-первых по принципу запрета Паули в одном квантовом состоянии не могут находиться два электрона с одинаковым набором четырех квантовых чисел n, l, me, mc. Этот принцип распространяется только для фермионов, для частиц с полуцелым спином, антисимметричной волновой функцией. Для бозонов (для частиц с целым спином, симметричной волновой функцией этот принцип не работает).
Другими словами кванто-механическая формулировка принципа запрета Паули гласит следующим образом: система фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями.
Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме, различаются значениями по крайней мере одного квантового числа.
Правило Хунда формулируется следующим образом.
Среди термов, возникших из одной определенной конфигурации, низшую энергию имеет тот, который отвечает наибольшему значению S. Среди термов с одинаковыми S низшую энергию имеет тот, который отвечает наибольшему L [3,5].
Руководствуясь принципом запрета Паули и правилом Хунда можно теоретически полностью описать заполнение электронных оболочек атомов периодической структуры химических элементов Д.И. Менделеева. Это еще раз подтверждает огромные теоретические возможности и успехи квантовой механики, которая является основой современной физики.
Принцип запрета или как его называют в квантовой механике принцип Паули, который определяет конфигурацию внешних электронных оболочек атомов является неотьемлемой составной частью квантовой физики. Благодаря этому принципу запрета Паули можно теоретически предсказать все свойства химических элементов, хотя на практике эта задача требует более сложных математических расчетов.
Этот принцип запрета Паули используют не только физики, химики но и специалисты смежных и других наук. Здесь нужно отметить, что одно из существенных достижений квантовой теории заключается в использовании принципа запрета Паули для простого, но полного обьяснения свойств элементов на основе периодической таблицы.
Так как химические и некоторые физические свойства элементов обьясняются внешними (валентными) электронами в атомах, то периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах. Поэтому для обьяснения таблицы будем считать, что каждый последующий элемент образован из предыдущего прибавлением к ядру одного протона и соответственно прибавлением одного электрона в электронной оболочке атома. Взаимодействием электронов пренебрегаем, внося, где это необходимо, соответствующие поправки. Рассмотрим атомы химических элементов, находящиеся в основном состоянии.
Во-первых для полного усвоения свойств химических элементов или электронных оболочек атомов приведем сам принцип запрета Паули, который формулируется следующим образом: в одном квантовом состоянии не может быть более одного электрона, который описывается следующими четырьмя квантовыми числами: n, l, me, mc или, другими словами, можно описать следующим образом: в одном атоме не может быть двух электронов с одним и тем же набором четырех квантовых чисел: n, l, me, mc. Этот гениальный принцип Паули сформулировал на основании анализа опытных данных еще до появления квантовой механики. Принцип Паули определяет статистическое поведение частиц с полуцелым спином (электроны,протоны, нейтроны и т.д.), которые описываются антисимметричной волновой функцией (фермионы) [1, 2].
Во-вторых нужно отметить, что не все частицы частицы подчиняются принципу запрета Паули. Другие частицы, свойства которых не согласуются с принципом запрета Паули, подчиняются статистике Бозе-Эйнштейна, их называют бозонами (фотоны, альфа частицы, атомы которые состоят из одинакового числа протонов и нейтронов). Здесь например можно наглядно обьяснить почему альфа-частица не подчиняется принципу Паули, альфа-частица как известно – это ядра Гелия, она состоит из двух протонов и двух нейтронов, так как протон и нейтрон – это фермионы, со спином 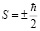 , тогда суммарный спин ядра Гелия получается либо нуль, либо единица (һ), значит альфа-частица относится к бозона, у которых спин либо нуль, либо единица.
, тогда суммарный спин ядра Гелия получается либо нуль, либо единица (һ), значит альфа-частица относится к бозона, у которых спин либо нуль, либо единица.
В данном вопросе мы должны подробно обьяснить, что такое спин, для чего он вводится. Спин –это чисто кванто-механическое свойство микрочастицы, оно не имеет классического аналога. Теоретически было предсказано и экспериментально было подтверждено, что у каждого электрона имеется собственный момент импульса, или спин, равный,
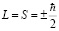 .
.
Следует отметить, что он составляет половину обычного значения орбитального момента. Это похоже на то, как если бы электрон представлял собой сферу, вращающуюся вокруг собственной оси с постоянным моментом
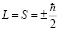 .
.
Этот собственный момент, или спин, невозможно ни уменьшить, ни увеличить.Он одинаков у всех элементарных частиц данного типа [3,4].
Вскоре после того, как был открыт спин электрона, Паули и Дирак разработали релятивистскую теорию частиц для фермионов, с антисимметричной волновой функцией, и с радостью обнаружили, что условие релятивистской инвариантности приводит к волновым функциям электрона, которые автоматически удовлетворяют принципу запрета Паули. Это означало, что принцип запрета Паули не был взят с потолка! Это был блестящий успех Вольфганга Паули [3,4]!
У частицы со спином 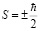 проекция ее на ось z могут принимать лишь одно из двух значений. Эта величина проекции спина необходима для полной характеристики состояния электрона или фермионов.
проекция ее на ось z могут принимать лишь одно из двух значений. Эта величина проекции спина необходима для полной характеристики состояния электрона или фермионов.
Для полного описания состояния атома необходимо знать четыре квантовых числа: первые три получаются из уравнения Шредингера, а последнее – спиновое квантовое число – из релятивистской теории электрона, разработанной Дираком [1,2].
Известно, что по классической теории электроны находятся в наиболее устойчивом состоянии, если они занимают самый нижний, т.е. основной энергетический уровень. Отсюда следует, что и электрон водорода, и многочисленные электроны самых тяжелых химических элементов должны распологаться на первой орбите, радиус которой уменьшается с увеличением атомной массы элемента.
Но фактически все атомы по своим размерам примерно одинаковые. Уровни энергии с соответствующими квантовыми числами распологаются таким образом, что образуют оболочки и подоболочки, в этих уровнях ориентация спинов электронов бывает различной, это означает что соблюдается принцип запрета Паули.
В принципе в периодической таблице элементы расположены по правилам, которые первоначально основывались на их химических свойствах и атомных весах. Однако, в действительности решающий фактор имеет не атомный вес, а атомный номер Z, т.е. число электронов, которые обращаются вокруг ядра. Одним из наиболее важных применений принципа Паули является обьяснение оболочечной структуры атомов, т.е. свойства, выражающегося в периодичности химических свойств атомов.
Следуя Нильсу Бору, мы будем развивать теорию периодической системы, шаг за шагом переходя от простых элементов к следующим, более сложным элементам. Поэтому в начале каждого шага мы имеем элемент с известной конфигурацией, затем предпологаем, что заряд ядра этого атома увеличился на единицу и одновременно на периферии электронной оболочки появился еще один электрон. Собственно таким образом происходит и заполнение электронных оболочек.
Например самый простейший элемент – водород (Z=1). Его электрон в основном состоянии находится на нижней орбите, поэтому его главное квантовое число 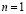 , мы говорим, что электрон находится на К-оболочке. Теперь при переходе к гелию появляется второй электрон, для обоих этих электронов
, мы говорим, что электрон находится на К-оболочке. Теперь при переходе к гелию появляется второй электрон, для обоих этих электронов 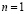 , и поэтому
, и поэтому 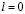 , а также и μ=0. Отсюда по принципу запрета Паули следует, что они должны иметь разные знаки спинов. Так как существуют только два возможных значения
, а также и μ=0. Отсюда по принципу запрета Паули следует, что они должны иметь разные знаки спинов. Так как существуют только два возможных значения
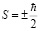 ,
,
то в К-оболочке имеются места только для двух электронов [4].
Если теперь прибавить третий электрон, то ему не найдется места в К-оболочке, и он должен поселиться на L-оболочке. Во-первых, как и в К-оболочке, на L-оболочке имеются два электрона с 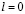 , они отличаются друг от друга только компонентами спина. Далее есть еще 6 мест для электронов с
, они отличаются друг от друга только компонентами спина. Далее есть еще 6 мест для электронов с 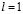 , так как μ, конечно, может иметь три значения: –1,0, 1, и для каждого из них возможны две ориентации спинов.
, так как μ, конечно, может иметь три значения: –1,0, 1, и для каждого из них возможны две ориентации спинов.
Таким образом, всего в L-оболочке 8 мест, и они подразделяются на две подоболочки с двумя и шестью электронами. Таким путем происходит и заполнение других подоболочек. Здесь нужно отметить, что в каждой оболочке может находиться только определенное количество электронов. Поэтому максимальное число электронов, которые имеют данное данное главное квантовое число n, равно 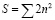 , поэтому число электронов получается 2, 8,18,32, 50 [3].
, поэтому число электронов получается 2, 8,18,32, 50 [3].
Подводя итоги можно сказать, что заполнение оболочек электронами строится по такой схеме: каждый вновь присоединяющийся электрон связывается в состоянии с наиментшими допустимыми принципом Паули квантовыми числами n, l.
Когда заполнение оболочки закончено, образуется устойчивая электронная конфигурация, соответствующая электронной конфигурации благородных газов. После этого начинает заполняться следующая оболочка, причем первым элементом при этом является щелочной металл. Здесь нужно отметить, что при заполнении оболочек электронами кроме принципа запрета Паули еще существует так называемый правило Хунда.
Теперь выясним что это за правило, и какую роль она играет в расположении электронов.Правило Хунда формулируется таким образом: среди термов, возникших из одной определенной конфигурации, низшую энергию имеет тот, который соответствует наибольшему значению S. Среди термов, с одинаковыми S низшую энергию имеет тот, который соответствует наибольшему L [1,3].
Таким образом, можно сказать, что заполнение электронных оболочек атомов происходит не простым путем, она имеет строгую определенную закономерность, подчиняющаяся принципу запрета Паули и правилу Хунда.
В целом, открытая Менделеевым периодичность в химических свойствах элементов обьясняется повторяемостью в структуре внешних оболочек у атомов родственных элементов.
Так, инертные газы имеют одинаковые внешние оболочки из 8 электронов (заполненные S и Р состояния), во внешней оболочке щелочных металлов имеется лишь один S-электрон, во внешней оболочке щелочно-земельных металлов имеется два S-электрона, галоиды имеют внешние оболочки, в которых недостает одного электрона до оболочки инертного газа, и т.д.

