Известно, что основным препятствием ускорения процессов электроосаждения металлов и сплавов является низкая скорость массопереноса реагентов к поверхности катода. Применяемые способы интенсификации гальванических процессов не всегда технически и экономически приемлемы из-за присущих им недостатков. Например, ухудшается равномерность распределения покрытия по поверхности изделия, увеличиваются материальные и энергетические затраты, ухудшаются условия труда и др.
Влияние различных факторов, в частности, состава электролита, наличия ультрадисперсных соединений, режимов нанесения и др. на свойства композиционных покрытий, полученных электролизом и химическим осаждением, изучали в [1, 7-12, 17, 18]. Для композиционных покрытий отмечен синергический эффект, заключающийся в улучшении антифрикционных и износостойких свойств по сравнению с аддитивной моделью [17, 20-23]. Однако, неясен механизм осаждения металла из растворов, обуславливающий повышенные физико-химические и физико-механические характеристики данных покрытий.
Влияние тонкодисперсных соединений электроосаждаемых металлов, восстанавливающихся на катоде одновременно с ионами этих металлов, заключается в изменении механизма получения гальванопокрытий, приводящего к интенсификации процесса, если лимитирующей его стадией является диффузия [13]. При этом изменяются поляризация, свойства гальванических осадков, зависимость их, а также свойств электролитов от состава и особенностей тонких дисперсий, способа и механизма их возникновения и т.д. Механизм рассматриваемых явлений отличается большой сложностью и влиянием на него многих факторов, которые трудно учесть теоретически и использовать на практике. Этими факторами являются размер и стабильность тонкодисперсных частиц соединений металла, их дисперсность, морфология, собственная электропроводность и диэлектрическая постоянная, напряженность электрического поля в трудноразмешиваемой части диффузионного приэлектродного слоя катода и др.
В электролитах никелирования тонкодисперсные соединения электроосаждаемого металла могут возникать в электролите при его приготовлении, при растворении анода, за счет изменения рН в прикатодных слоях в процессе электролиза. В работе авторов [4] показано, что при электроосаждении никеля происходит подщелачивание прикатодного слоя и появляются условия образования высокодисперсных золей гидроксида никеля, толщина которых превышает толщину диффузионного слоя. Наличие золей подтверждено с помощью электронного микроскопа. Установлено, что на покрытиях присутствует гидроксид никеля (Ni(OH)2), который образуется во время электролиза. Чувствительным методом радиоактивных изотопов установлено присутствие гидроксидных соединений на никелевых гальванических осадках. Количество никелевого покрытия соизмеримо с количеством никеля в составе гидроксида при малых толщинах, а затем, с увеличением толщины слоя концентрация никеля, падает. Даже на свежеосажденном никеле после промывки в воде на поверхности имеется пленка гидроксида толщиной примерно 0,06 г/м2 в пересчете на никель. Это говорит о том, что при электролизе на поверхности электрода находится пленка, которая экранирует поверхность и тем самым затрудняет подвод к электроду из прикатодного слоя катионов никеля.
Массоперенос дисперсных частиц к катоду и образование их в приэлектродном слое и на самом электроде за счет протекания вторичных реакций открывает возможности для осуществления эффекта, который приводит к возникновению потоков ионов, в том числе потоков разряжающихся ионов, а также жидкости в слабо размешиваемой части диффузионного слоя электрода. Данная жидкость преимущественно и представляет наибольшие затруднения для массопереноса конвекцией. При определенной концентрации дисперсной фазы тонкодисперсные системы в диффузионном слое можно рассматривать как подвижную систему пор. Такие системы, помимо того, что их элементы восстанавливаются на катоде, обеспечивают возможность возникновения равновесных и неравновесных электроповерхностных явлений, которые могут существенно увеличивать массоперенос по сравнению с предельным током диффузии. Это – явления электроосмоса и электрофореза, возможно также диэлектрофореза, диполофореза, диффузиофореза, приводящие к возникновению потоков ионов, частиц и своеобразного эффективного размешивания прилегающей к катоду части диффузионного слоя, в которой очень низка скорость конвекции и которая представляет наибольшие затруднения для массопереноса.
С целью накопления нового фактического материала, позволяющего установить реализуемый механизм, изучено влияние температуры на процесс электроосаждения никеля из низкоконцентрированного хлоридного электролита.
Материалы и методы исследования
Для исследований использовали электролит состава, г/л: хлорид никеля шестиводный 100, борная кислота 35, хлорид аммония 20, хлорамин Б 1,0, КОБ 5, рН 1,0 – 5,0 и температура 20 – 60°С. Электролит готовили из реактивов квалификации «чда» и дистиллированной воды.
Поляризационные зависимости получали потенциодинамическим методом с помощью потенциостата ПИ-50-1.1 со скоростью развертки потенциала 1 мВ/с. Для получения хронопотенциограмм использовали потенциостат ПИ-50-1.1 с программатором ПР-8, синхронизированный с запоминающим устройством (осциллографом С-8-12). Все измерения проводили в электрохимической ячейке ЯСЭ-2, которую термостатировали с помощью ультратермостата UTU-4. В качестве исследуемых электродов использовали никелевые пластинки с рабочей поверхностью 3×3 мм (хронопотенциометрические измерения) и 10х10 мм (поляризационные измерения). Нерабочие стороны электродов изолировали эпоксидным компаундом. Потенциал исследуемых электродов измеряли относительно хлорсеребряного электрода сравнения и пересчитывали на водородную шкалу потенциалов.
Для исключения влияния естественной конвекции, при хронопотенциометрических измерениях плотность тока выбирали таким образом, чтобы переходное время не превышало 1 мин [5]. Измерение рН прикатодного слоя производили, используя метод металловодородного электрода [2].
Результаты исследования и их обсуждение
Электроосаждение никеля из хлоридного электролита сопровождается увеличением рН прикатодного слоя до 5,8 – 6,8 в рабочих областях катодных плоностей тока при рН в объеме электролита 1,0, что приводит к образованию в прикатодном слое тонкодисперсных систем основных соединений никеля.
Методом хронопотенциометрии получены зависимости переходного времени от плотности тока при различных температурах электролита. На рис. 1 приведена зависимость величины произведения j·τ1/2 от плотности тока для низкоконцентрированного хлоридного электролита при различных температурах. Как видно из хода этих кривых произведение j·τ1/2 не зависит от плотности тока как при комнатной, так и при других температурах.
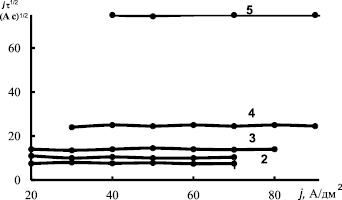
Рис. 1. Зависимость величины произведения j·τ1/2 от плотности тока в электролите состава, г/л: хлорид никеля шестиводный 100, борная кислота 35, хлорид аммония 20, хлорамин Б 1,0, КОБ 5, рН 1,0, температурах, оС: 1 – 20, 2 – 30, 3 – 40, 5 – 60
На рис. 2 приведена зависимость величины произведения j·τ1/2 от температуры. Для процессов, контролируемых диффузией, скорость массопереноса пропорциональна квадрату произведения j·τ1/2. При повышении температуры от 20 до 50оС скорость массопереноса увеличивается в примерно 3,5 раза, а в интервале температур от 50 до 60оС скорость возрастает почти в 3,1 раза. Общее увеличение скорости массопереноса при повышении температуры от 20 до 60оС происходит примерно в 11 раз. Из экспериментальных данных следует, что скорость процесса электроосаждения никеля из хлоридного электролита в отсутствии искусственной конвекции лимитируется стадией массопереноса никельсодержащих частиц из объема электролита к поверхности катода. Скорость массопереноса как при комнатной, так и при повышенных температурах, в отсутствии КОБ не изменяется, и зависимость произведения j·τ1/2 от плотности тока остается такой же.
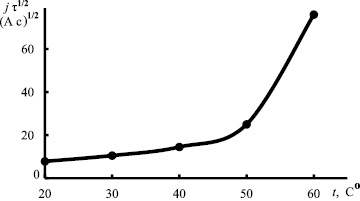
Рис. 2. Зависимость величины произведения j·τ1/2 от температуры электролита состава, хлорид никеля шестиводный 100, борная кислота 35, хлорид аммония 20, хлорамин Б 1,0, КОБ 5, рН 1,0
Полученные экспериментальные данные могут позволить установить механизм процесса электроосаждения никеля в рассмотренных условиях. Так, если рассчитать по уравнению Сэнда [6] коэффициент диффузии ионов никеля при температуре 25оС, получим значение 0,42·10–9 м2/с, которое согласуется со справочными данными (для разбавленных растворов D = 0,69·10–9 м2/с) [16]. Подобный расчет для 60оС дает значение D = 36,1·10–9 м2/с, которое маловероятно, поскольку истинный коэффициент диффузии в исследуемом интервале температур более вяло (линейно) зависит от температуры. Следовательно, при температуре 60 оС разряжающиеся соединения никеля доставляются к поверхности катода не за счет диффузии.
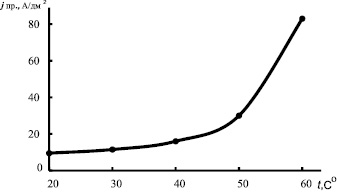
Рис. 3. Зависимость предельной плотности тока от температуры в электролите состава, г/л: хлорид никеля шестиводный 100, борная кислота 35, хлорид аммония 20, хлорамин Б 1,0, КОБ 5 при рН 1,0
Резкое возрастание произведения j·τ1/2, а, следовательно, и скорости массопереноса при повышенных температурах (особенно при температуре свыше 40оС) может быть обусловлено и особым механизмом доставки ионов в присутствии коллоидов [13]. При температурах выше 40оС, вероятно, за счет гидролиза, образуется высокодисперсная твердая фаза, состоящая из основных соединений никеля. Значительное увеличение количества дисперсных частиц в хлоридном электролите никелирования при повышении температуры от 20 до 60 оС наблюдали авторы работы [14].
Дополнительно для определения природы замедленной стадии использован метод хроновольтамперометрии. Наличия нелинейной зависимости предельной плотности тока от скорости изменения потенциала от 20 до 80 мВ/с [3, 5] в степени ½ (j = f(V1/2)) указывает на недиффузионные затруднения процесса.
На такой механизм процесса указывают также высокие температурные коэффициенты, составляющие при рН 1,0 для интервала температур 20 – 60°С – 2,3 % на градус, для интервала температур 50 – 60 оС – 6,4 % на градус (рис. 3). Температурный коэффициент W=100×Djпр./jпр.×Δtо для предельного диффузионного тока обычно составляет 1,6 – 1,9 % на градус (для ионов водорода – лишь 1,19 % на градус) [15]. Конечно, по потенциодинамическим измерениям на твёрдых электродах о температурных коэффициентах можно судить лишь приближенно. Однако величины их в рассматриваемом случае весьма высоки.
Увеличение массопереноса в низко концентрированном хлоридном электролите никелирования с рН 1,0 при повышении температуры от 20 до 60 оС объясняется усилением гидролиза солей никеля [19] и большей вероятностью образования эффективной подвижной системы пор из восстанавливающихся на катоде тонкодисперсных систем соединений никеля в прикатодном слое.
Скорость процесса лимитируется активационными ограничениями; не ясно, с чем связано возникновение предельных плотностей тока на поляризационных характеристиках. Тут возможны два предположения:
1) предельная катодная плотность тока является предельным кинетическим током, вызванным замедленностью предшествующего распада тонкодисперсных соединений у поверхности электрода;
2) предельная катодная плотность тока возникает потому, что возрастание напряженности электрического поля у катода при высоких плотностях тока приводит к быстрой коагуляции тонкодисперсных систем у катода, а это нарушает оптимальную подвижную систему пор в прикатодном пространстве, которая может привести к возникновению электроповерхностных явлений и интенсификации электроосаждения никеля.
Известно, что в растворах электролитов при повышении температуры возрастает предельная плотность тока диффузии. В хлоридных электролитах предельная рабочая плотность тока в этом случае на два порядка выше, что указывает на особый механизм восстановления ионов никеля в этих растворах.
Выводы
Электроосаждение никеля из хлоридного электролита приводит к образованию в прикатодном слое тонкодисперсной системы основных соединений никеля, которые оказывают влияние на скорость массопереноса разряжающихся тонкодисперсных частиц электроосаждаемого металла.
Cкорость процесса электроосаждения никеля из хлоридного электролита в отсутствии искусственной конвекции лимитируется стадией массопереноса никельсодержащих частиц из объема электролита к поверхности катода.
Cкорость массопереноса при повышенных температурах (особенно при температуре свыше 40 °С) может быть обусловлена механизмом доставки ионов в присутствии коллоидов и тонкодисперсных соединений электроосаждаемого металла, а также за счет гидролиза и образования высокодисперсной твердой фазы, состоящей из основных соединений никеля.

