Молекулярно-генетичекие методы в микробиологии применяются сравнительно недавно, однако в настоящее время они занимают ведущие позиции при индикации и идентификации бактерий и вирусов [4–6].
Среди генетических методов очень важным является рестрикционный анализ бактериальной ДНК, который широко используется в молекулярно-биологических исследованиях и прикладных работах и является одним из наиболее важных инструментов при изучении ДНК [6, 7]. Как правило, продукты расщепления ДНК анализируются с помощью гель-электрофореза в агарозном или акриламидном геле, а полученная таким образом картина разделения фрагментов ДНК в виде определенного, отличающегося для разных ферментов, набора полос и является результатом рестрикционного анализа той или иной ДНК [1]. Большое разнообразие существующих эндонуклеаз рестрикции (ЭР) позволяет проводить расщепление ДНК по более чем 150 сайтам узнавания [7, 6, 9].
Открытие и выделение рестрицирующих эндонуклеаз (рестриктаз), расщепляющих ДНК в участках со строго определенной последовательностью, позволило разработать специфические маркеры на основе фрагментарного анализа ДНК.
Отличительной особенностью этого метода является возможность построения молекулярно-генетических карт микроорганизмов, что при высокой степени воспроизводимости может быть использовано при видовой идентификации.
В последние годы в России официально регистрируется более 1,2 миллиона больных различными паразитоценозами, среди которых отмечается рост заболеваемости кишечными протозоозами [1, 2, 5]. Ситуация усугубляется тем, что помимо классических паразитарных болезней появляются новые паразитозы, в частности бластоцистоз, обусловленный паразитированием в толстом кишечнике простейших Blastocystis spp. Для определения этиологической значимости бластоцист в развитии инфекции проводят изучение вирулентности простейших [2, 4, 8].
До настоящего времени изучение вирулентности Blastocystis spp. проводили биологическими методами исследования, которые позволяют оценить только потенциальную роль простейших в развитии инфекции [3, 10]. Было бы интересным произвести определение степени вирулентности простейших Blastocystis spp. с применением метода, основанного на анализе полиморфизма длин фрагментов рестрикции (ПДФР) ДНК простейших.
В связи с этим целью нашей работы являлось изучение возможности использования данного метода для типирования вирулентных и авирулентных форм бластоцист.
Материалы и методы исследования
Для проведения рестрикционного анализа необходимо было получить максимальное количество бактериальной ДНК, что определяет сама специфика метода, поэтому при проведении экспериментов нами были использованы различные методы выделения ДНК: термический метод клеточной денатурации, сорбентный метод с использованием в качестве носителя силикагеля, фенольно-хлороформная экстракция. В итоге было определено, что наибольший выход ДНК наблюдался при использовании фенольно-хлороформной методики выделения [5].
Выделение ДНК проводили согласно инструкции по применению комплекта реагентов для выделения ДНК, утвержденной приказом Росздравнадзора от 30 июня 2008 г. № 5008-Пр/08, регистрационное удостоверение МЗ СР РФ № ФСР 2008/02938.
Фенольно-хлороформная экстракция для выделения ДНК бластоцист осуществлялась с применением наборов «ВекторДНК-экстракция», ЗАО «Вектор-Бест» (пос. Кольцево Новосибирской области).
В эксперименте использовали чистые культуры бластоцист, выращенные на среде Surech. Для установления оптимального срока обработки исследуемого материала было проведено выделение ДНК через сутки после хранения при t = –20 °С.
В работе были использованы рестриктирующие эндонуклеазы (рестриктазы): EcoR I, BamH I, Hae III, Hind III, Pst I, производство НПО «СибЭнзим», г. Новосибирск (info@sibenzyme.ru), в соответствующем буфере. Реакцию останавливали добавлением 5 мкл стоп раствора, содержащего 0,1 М ЭДТА, 0,05 % бромфенолового синего и 40 % сахарозы. Электрофоретическое разделение продуктов рестрикции амплифицированной ДНК проводили в 2 % агарозе (Sigma) в трис-ацетатном буфере с этидий бромидом (0,5 мг/л) при 120 V в течение 4 ч. Для определения длины фрагментов ДНК использовали маркеры молекулярного веса ДНК (100bp + 1,5 Kb ДНК маркеры, НПО «СибЭнзим»). Определение длин полученных рестриктов осуществляли с помощью компьютерной программы Gel Pro Analyzer, версия 4.0.00.001. Процент идентичности длин фрагментов рассчитывали для каждой пары микроорганизмов, сравнивая картины рестрикции отдельно по каждой рестриктазе. При сравнении длин рестриктов идентичными считали фрагменты ДНК, длина которых различалась не более чем на 5 %.
Статистическую обработку данных проводили при помощи программы «Statistica for Windows».
Результаты исследования и их обсуждения
В результате проведенных экспериментов с использованием различных рестриктаз на экстрагированной ДНК авирулентных, слабовирулентных, умеренно-вирулентных и высоко-вирулентных штаммах бластоцист, выделенных из клинического материала больных, установили, что при использовании рестриктазы BamH I – G▼ˉ GATCC/CCTAG ▲ˉG на дорожках 1 % агарозного геля наблюдались полосы, окрашенные бромистым этидием, ДНК размером около 10 000 п.н. (рис. 1). Коротких фрагментов хромосомной ДНК бластоцист размером 100–10 000 п.н. в ходе эксперимента мы не наблюдали.
Сайт узнавания рестриктазы Hae III – GG▼ˉCC/CC▲GG представлен на рис. 2. При проведении реакции с экстрагированной тотальной ДНК бластоцист с различной степенью выраженности вирулентности нами были получены следующие результаты: на дорожках агарозного геля после электрофореза у авирулентных бластоцист ясно выражены фрагменты ДНК размером около 850 и 10 000 п.н.; в остальных дорожках ДНК бластоцист с различной степенью выраженности вирулентности кроме этих фрагментов наблюдались полосы с размерами от 1500 до 10 000 п.н.
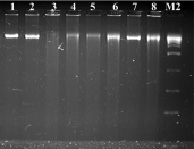
Рис. 1. Электрофореграмма рестрикционных фрагментов ДНК штаммов бластоцист с использованием рестриктазы BamH I. Штаммы бластоцист: 1, 2 – авирулентные, 3, 4 – слабо-вирулентные, 5, 6 – умеренно-вирулентные, 7, 8 – высоко-вирулентные. М2-маркер молекулярного веса – 300–10000 п.н.
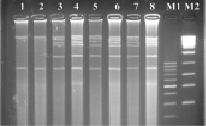
Рис. 2. Электрофореграмма рестрикционных фрагментов ДНК штаммов бластоцист с использованием рестриктазы Hae III. Штаммы бластоцист: 1, 2 – авирулентные; 3, 4 – слабо-вирулентные; 5, 6 – умеренно-вирулентные; 7, 8 – высоко-вирулентные. М1-маркер молекулярного веса – 100–1000 п.н., М2-маркер молекулярного веса – 300–10000 п.н.
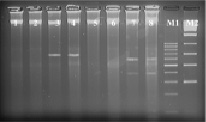
Рис. 3. Электрофореграмма рестрикционных фрагментов ДНК штаммов бластоцист с использованием рестриктазы Hind III. Штаммы бластоцист: 1, 2 – авирулентные; 3, 4 – слабо-вирулентные; 5, 6 – умеренно-вирулентные; 7, 8 – высоко-вирулентные. М1-маркер молекулярного веса – 100–1000 п.н., М2-маркер молекулярного веса – 300–10000 п.н.
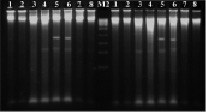
Рис. 4. Электрофореграмма рестрикционных фрагментов ДНК штаммов бластоцист с использованием рестриктазы Pst I. Штаммы бластоцист: 1, 2 – авирулентные; 3, 4 – слабо-вирулентные; 5, 6 – умеренно-вирулентные; 7, 8 – высоко-вирулентные. М2-маркер молекулярного веса – 300–10000 п.н.

Рис. 5. Электрофореграмма рестрикционных фрагментов ДНК штаммов бластоцист с использованием рестриктазы EcoR I. Штаммы бластоцист: 1–4 – авирулентные; 5–8 – слабо-вирулентные; 9–12 – умеренно-вирулентные; 13–16 – высоко-вирулентные. М1-маркер молекулярного веса – 100–1000 п.н., М2-маркер молекулярного веса – 300–10000 п.н.
Следовательно, данная рестриктаза позволяет дифференцировать авирулентные и вирулентные штаммы бластоцист без выявления выраженности вирулентных свойств.
При использовании рестриктазы Hind III – A▼ˉAGCTT/TTCGA▲A на дорожках 1 % агарозного геля наблюдались полосы размером от 10 000 и более п.н., окрашенные бромистым этидием (рис. 3). Кроме этого, на дорожках ДНК слабовирулентных штаммов бластоцист наблюдалась полоса размером 700 п.н.; на дорожках агарозы ДНК высовирулентных штаммов бластоцист выявлялись две полосы 380 и 600 п.н. Следовательно, рестриктаза Hind III позволяет выявить слабо- и высоковирулентные простейшие.
При проведении экспериментов рестрицирования (расщепления с помощью эндонуклеаз) выделенной ДНК штаммов бластоцист рестриктазы Pst I – CTGCA▼ˉG/G▲ˉACGTC нами были получены следующие результаты: на дорожках агарозного геля штаммов бластоцист с различной степенью выраженности вирулентности наблюдались яркие размытые полосы (шмеры) размером от 2000 до 10 000 (на отдельных дорожках и более) п.н. (рис. 4). Однако на дорожках хромосомной ДНК умеренно-вирулентных бластоцист наблюдали фрагменты размером около 900 п.н. У других штаммов бластоцист таких полос не обнаруживалось. Таким образом, рестриктаза Pst I позволила выявить только умеренно-вирулентные штаммы Blastocystis spp.
При использовании рестриктазы EcoR I с сайтом узнавания G▼ˉAATTC/CTTAA▲ˉG на дорожках 1 % агарозного геля штаммов бластоцист с различной степнью выраженности вирулентности наблюдали полосы шмер по всей длине дорожек, свидетельстующие о множественных фрагментах ДНК различной длины, перекрывающих друг друга (рис. 5). Таким образом, можно сделать заключение о наличии в структуре ДНК всех штаммов бластоцист множественных сайтов GAATTC/CTTAAG, что свидетельствует о невозможности выявления степени вирулентность бластоцист при помощи рестриктазы EcoR I.
Величина фрагментов ДНК бластоцист с различной степенью проявления вирулентности (п.н.)
|
Штаммы бластоцист |
Величина фрагментов ДНК при действии рестриктаз |
||||
|
BamH I |
Hae III |
Hind III |
Pst I |
EcoR I |
|
|
Авирулентные |
10 000 |
850, 10 000 |
10 000 и более |
от 2000 до 10 000 |
Сплошной шмер |
|
Слабовирулентные |
10 000 |
от 550 до 10 000 |
700, 10 000 и более |
от 2000 до 10 000 |
Сплошной шмер |
|
Умеренновирулентные |
10 000 |
от 550 до 10 000 |
10 000 и более |
от 2000 до 10 000, 900 |
Сплошной шмер |
|
Высоковирулентные |
10 000 |
от 550 до 10 000 |
380, 600, 10 000 и более |
от 2000 до 10 000 |
Сплошной шмер |
В таблице представлены результаты определения вирулентности штаммов бластоцист, полученных методом рестрикционного анализа ДНК простейших с использованием рестрицирующих эндонуклеаз (рестриктаз): EcoR I, BamH I, Hae III, Hind III, Pst I.
В работе предложен метод определения вирулентности Blastocystis spp., основанный на анализе полиморфизма длин фрагментов рестрикции (ПДФР) ПЦР-продукта длиной 10 000 пар нуклеотидов, полученного при выделении ДНК простейших с применением пяти эндонуклеаз рестрикции EcoR I, BamH I, Hae III, Hind III, Pst I.
Заключение
Таким образом, рестрикционный анализ показал, что использование рестриктаз BamH I, EcoR I, Pst I не позволяет типировать бластоцисты с различной степенью выраженности вирулентности.
Использование рестриктазы Hae III позволяет проводить дифференциацию авирулентных и вирулентных бластоцист на основе отсутствия или наличия фрагментов ДНК размером от 1500 до 10000 п.н.
При помощи рестриктазы Pst I произведено типирование бластоцист с умеренно выраженной вирулентностью на основе наличия фрагментов ДНК размером около 1000 п.н.
В эксперименте с применением рестриктазы Hind III, было произведено типирование бластоцист со слабовыраженной вирулентностью на основе фрагментов ДНК размером 700 п.н., а также высоко-вирулентных штаммов бластоцист на основе наличия фрагментов ДНК размером 380 и 600 п.н.
Полученные результаты показывают, что предложенная комбинация эндонуклеаз рестрикции (Hae III, Pst I и Hind III) для определения вирулентности Blastocystis spp. может служить достаточно простым и универсальным способом идентификации простейших в зависимости от степени выраженности вирулентных свойств. Кроме того, метод рестрикционного анализа гораздо более чувствителен и позволяет изучить не только потенциально патогенные штаммы бластоцист, которые выявляются биологическими методами исследования, но и выявить весь спектр генов в геноме бластоцист, обладающих свойствами патогенности.
Работа выполнена при поддержке ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы (№ 14.B37.21.2010).
Библиографическая ссылка
Бугеро Н.В. СОВРЕМЕННЫЙ МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ ПОДХОД ОПРЕДЕЛЕНИЯ ВИРУЛЕНТНОСТИ ПРОСТЕЙШИХ // Международный журнал экспериментального образования. 2016. № 5-3. С. 305-308;URL: https://expeducation.ru/ru/article/view?id=10018 (дата обращения: 08.03.2026).

