При обогащении гравитационным методом сурьмяных отходов [5] (штейна и шлака) легкие фракции концентрации сурьмы увеличиваются до 30–35 % в штейне, а в шлаке до 25–27 %. Кроме этого в отходах остается 3 % мышьяка и 30 % железа, которые сильно мешают получению металлической сурьмы и поэтому в данной работе использовали химический метод осаждения мышьяка и железа. В данной работе после гравитации легких фракций сначала проводились выщелачивание, отстаивание, сгущения и фильтрация электролитов, так как в последние время все больше применение находить гидрометаллургический способ получения металлической сурьмы. Этим способом перерабатывают сурьмяные концентраты, промышленные продукты пирометаллургических процессов, а также определяет содержание сурьмы в отходах, промышленных продуктах для производства других цветных металлов.
В процессе гравитации сурьмяных отходов в легкие фракции обогащается металлическая сурьма, которая не растворяется в сульфидно-щелочных растворах. Поэтому именно растворением Sb (или Sb2О3) в горячей концентрированной кислоте может быть получен нормальный сульфат сурьмы Sb2(SO4)3. С небольшим количеством воды эта соль дает кристаллогидрат, при дальнейшем же разбавлении раствора сперва образуется сульфат антимонила [(Sb2)SO4], а затем наступает дальнейший гидролиз.
В дальнейшем в качестве растворителя сурьмы могут быть использованы растворы сульфидов щелочных и щелочно-земельных металлов, а также растворы едкого натра. При растворении трехсернистой сурьмы протекают следующие реакции:
Sb2S3+3Na2S=2Na3SbS3;
Sb2S3+4NaOH=NaSbO2+ Na3SbS3+2H2O.
В промышленности растворы едкого и сернистого натрия нашли применение в качестве растворителя.
1. Выщелачивание сурьмы
Известно, что выщелачивание это процесс растворение в жидком растворителе одного или нескольких составляющих твердого материала. А в производстве сурьмы под выщелачиванием подразумевается совокупность следующих операций:
Растворение минералов в качестве растворителя качества. Применяется слабый раствор сернистого натрия (Na2S) и едкого натрия (NaOH). При одновременном присутствии в растворе двух растворителей – сернистого натрия и едкого натра соединения сурьмы растворяются сначала сернистым натрием, и только при отсутствии его избытка в растворении начинает участвовать и едкий натрий.
Важную роль в процессе выщелачивание играют температурные условия реакции растворения всех форм сурьмы в сернистом натрии идет значительно быстрее с повышением температуры: для растворения окисленных форм температуры пульпы должна быть не ниже 95°C более 1,5 часа.
Продолжительность выщелачивания зависит от размеров и пористости частиц сырья. Установлено, что для сурьмы содержащего штейна крупностью 5 мм время выщелачивания составляет 0,5 часов.
Для выщелачивания сурьмяных отходов используется различные концентрации растворов, например, если в одном литре 4 г/л Sb, то применяются 17 г/л сернистого натрия и 6,5 г/л едкого натрия.
Для ускорения растворения сурьмы пульпe (смесь твердого выщелачиваемого материала с раствором), перемешивают смесь мешалками в реакторе для выщелачивания (рис. 1) [4].
2. Отстаивание и сгущение пульпы
Пульпа после выщелачивания представляет собой смесь раствора солей сурьмы и твердого остатка не растворившейся части сырья.
Сгущение проводится в чанах большой емкости, так называемых сгустителях, в которых твердые частицы оседают под действием силы тяжести. В верхней части сгустителя образуется слой чистого раствора, который сливаются через край сгустителя в приемник. Твердые частицы оседают на дно, сгущенный продукт тем или иным способом удаляют из сгустителя. Качество сгущения характеризуется величиной «отстоя».
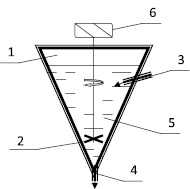
Рис. 1. Реактор для выщелачивания сурьмы: 1 – реактор; 2 – мешалка; 3 – водянной пар; 4 – раствор на сгуститель; 5 – растворитель электролит; 6 – электродвигатель
На скорость осветления и сгущения влияют температуры пульпы. С повышением температуры уменьшаются вязкость раствора (жидкой фазы), отчего повышается скорость осаждения.
Удовлетворительные показатели отстоя наблюдаются при температуре пульпы 70–80°С. Скорость осаждения зависит от плотности пульпы, отстаивается быстрее, чем плотные. На сгуститель дополнительно нами был закреплен цинковый лист для осаждения Fe+2 железа, этот процесс экономит химический реактив SnCl2.
О процессе отстаивание пульпы судят по скорости отстаивания, измеряемой в сантиметрах высоты осветленной части пульпы в стеклянном цилиндре за определенной промежуток времени, обычно за 30 мин [1].
3. Фильтрация электролита
Получающиеся при отстаивание в сгустителях богатый сурьмой раствор содержит твердые частицы в виде мути и взвеси в количестве более 1 г/л раствора. Присутствие взвесей в растворе не допустимо, т.к. ведет к нарушению процесса электролиза.
Фильтрование растворов, содержащих взвеси, затруднительно, так как обычно взвесь проходить через ткань. Поэтому, часто перед фильтрацией на фильтр ткань накладывает постель, т.е. слой крупных частиц материала и сгущенной пульпы фильтруют через такой «фильтр». При этом температура раствора перед фильтрацией поддерживается не ниже 60°С. Полученный хорошо осветленный раствор является прозрачной и имеет соломенный цвет [4].
Для Кадамжайского сурьмяного комбината наиважнейшей задачей получения металлической сурьмы является очистка и осаждения мышьяка и железа из электролита, поскольку они мешают получению катодного металла в процессе электролиза.
Для решения данной проблемы, нами разработана схема технологической отчистки и осаждение мышьяка и железа из промышленного отхода (штейна и шлака) химическим методом (рис. 2). В результате проведенных опытных исследований установлены:
1. Для извлечения и осаждения ионов мышьяка и железа использовали 16,5 % раствор магнезиальной смеси (MgCl2 + NH4Cl+ + NH4OH), в избытке гидроксида аммония и при этом происходит следующая реакция:
Na3AsO4 + MgCl2 + NH4OH= =NH4Mg AsO4v + NaCl + NaOH.
Магнезиальная смесь дает с арсенат – ионами белый кристаллический осадок арсената магния, аммония. А также в процессе реакции гидроксид аммоний осаждают катионов железа Fe+3:
Fe+3 + 3NH4OH>Fe(OH)3v + 3NH4^.
Гидроксид аммония осаждает Fe+3 железа – темно бурого осадка гидроксида железа III.
2. Для осаждения двух валентных ионов железа Fe+2 применяли 10 % раствор хлорид олова:
Fe+2 + SnCl2 = FeCl2v + Sn.
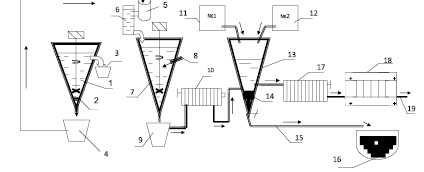
Рис. 2. Схемы технологической очистки и осаждения мышьяка и железа из промышленного отвала (штейн и шлак) химическим методом: 1 – гравитационный сеператор; 2 – магнит; 3 – легкая фракция; 4 – тяжелая фракция; 5 – загрузка штейна H2SO4 конц.; 6 – электролит Na2S и NaOH; 7 – реактор для выщелачивания; 8 – водянной пар; 9 – сгуститель; 10 – фильтпресс №1; 11 – №1 бачок для осаждения Asv Fe+3v; 12 – №2 бачок для осаждения Fe+2v; 13 – делительная емкость для осаждения мышьяка и железа; 14 – осадок соединение мышьяка и железа; 15 – отходная труба; 16 – отвал; 17 – фильтпресс №2; 18 – электролизная ванна; 19 – обратный электролит
10 % раствор хлорид олова осаждает Fe+2 железа коричневым осадком хлорида железа (II) [3].
3. После очистки мышьяка и железа, проводили контрольный анализ на ионы мышьяка и железа в электролите: определение содержания мышьяка (III) в растворе арсенита, с прямым йодометрическим титрованием:
Na3AsO3 + I2 + H2O - Na3AsO4 + 2HI.
Восстановительная эквивалентная масса арсенита равна 1/2 молярной массы, а эквивалентная масса мышьяка 74,91:2=37,46 г / моль.
Если на титрование 10мл 0,04696 Н раствора йода пошла в среднем 24,06 мл раствора арсенита натрия, то:
 .
.
Тогда масса мышьяка в 0,1 л раствора
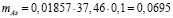 г.
г.
Для определения содержания железа Fe+2 и Fe+3 в электролите, сначала проводиться качественная реакция на железо Fe+2 и Fe+3 [3].
1. K3[Fe(CN)6] + Fe(OH)2 > отрицательно
Гексацианоферат (III) калий
(кроваво-красная соль)
В этой качественной реакции, если Fe+2 содержится в электролите, должно было давать темно синюю реакцию трунбулевый синий Fe3[Fe(CN)6]2 . .
2. K4[Fe(CN)6] + Fe(OH)3 > отрицательно
Гексацианоферат (II) калий
(желто-кровавая соль)
В этой качественной реакции, если содержится Fe+3 в электролите, должно было давать зеленый цвет реакция берлинская лазурь Fe4[Fe(CN)6]3.
Качественная реакция на ионы Fe+3 с применением раствора роданида калия (KSCN) тоже дает отрицательную реакцию [2].
Выводы
1. Изучены сурьмяные отходы КСК обогащения как нетрадиционного сырья для получения сурьмы и других ценных компонентов. Разработана технология гравитационного обогащения техногенных отходов и технологии их переработки.
2. Металлическая сурьма, содержащаяся в производственных отходах не растворяется в едком и сернистом натрии. Поэтому в работе для растворения металлической сурьмы использовали 12 мл концентрированной серной кислоты на 100 грамм щтейна с содержанием 10 % воды и нагревали, а также использовали растворы сульфидов и щелочноземельных металлов;
3. Установлено, что в процессе осаждающиеся реакции в реакторе осаждаются соединения мышьяка и железа. Показано, что после проведения осаждающего процесса в электролите содержится очень малое количества ионов мышьяка, а ионы Fe+2 и Fe+3 отсутствуют.
Библиографическая ссылка
Ысманов Э.М., Абдалиев У.К., Ташполотов Ы. ОСАЖДЕНИЕ МЫШЬЯКА И ЖЕЛЕЗА ИЗ ПРОМЫШЛЕННЫХ ОТХОДОВ (ШТЕЙНА И ШЛАКА) КАДАМЖАЙСКОГО СУРЬМЯНОГО КОМБИНАТА ХИМИЧЕСКИМ МЕТОДОМ // Международный журнал экспериментального образования. 2017. № 1. С. 44-47;URL: https://expeducation.ru/ru/article/view?id=11055 (дата обращения: 17.11.2025).

