Ранее было показано, что при госпитальном лечении пациентов лекарства вводятся в основном внутривенно в виде «Растворов для инъекций» без контроля температуры, осмотической активности и некоторых других характеристик качества лекарств [17, 22, 23, 25, 26, 28, 29, 30]. Причиной этих обстоятельств является отсутствие соответствующих требований в общепринятых стандартах внутривенных инъекций и, наоборот, наличие в них требований о первоначальном заполнении шприца выбранным лекарством, дополнении его порцией крови, изымаемой из вены пациента, и лишь о последующем введении содержимого шприца в вену [20, 21, 32]. Поэтому в вены пациентов вполне на законных основаниях повсеместно вводятся не столько «Растворы для инъекций», сколько холодные кроваво-лекарственные смеси [17, 19, 20, 22]. При этом сохранность крови внутри шприцов и динамика здоровья пациентов после введения в их вены кроваво-лекарственных смесей не анализируется [18, 19, 20, 21, 26, 27].
В то же время, ранее было показано, что увеличение длительности и температурного режима взаимодействия способствует повреждению тканей, и наоборот [1, 2, 6-16, 24]. Кроме этого, установлено, что качественные растворы для инъекций имеют в настоящее время кислотную активность в диапазоне значений рН 2, 8 – 11, 0 и осмотическую активность – в диапазоне 0 – 4000 мОсмоль/л воды, [4, 18, 19, 22]. Более того, показано, что кислотная и осмотическая активность качественных растворов для инъекций может быть равна щелочной и осмотической активности плазмы крови человека только по счастливой случайности [33, 34]. Причем, большинство растворов для инъекций имеет рН ниже 7, 4, а осмотическую активность – выше или ниже 280 мОсмоль/л воды [31, 32]. При этом многие растворы для инъекций являются чрезмерно кислыми и чрезмерно гиперосмотическими (гипертоническими), поэтому обладают физико-химической агрессивностью [35]. В частности, лекарства могут повреждать кожу в местах инъекций и вызывать ятрогенное заболевание, которое получило название «Инъекционная болезнь кожи» [33, 34].
Поэтому предполагается, что при внутривенных инъекциях некоторая часть качественных растворов для инъекций может повреждать эритроциты и плазму крови.
Цель исследования – изучение особенностей локального действия лекарств на эритроциты и плазму крови пациентов.
Материалы и методы исследования
В период с 2000 по 2013 год в бюджетных учреждениях здравоохранения города Ижевска при госпитальном лечении 500 пациентов в возрасте от 16 до 88 лет в терапевтических, хирургических, неврологических, гинекологических отделениях и в отделениях анестезиологии и реанимации исследована технология внутривенных инъекций лекарственных средств, при госпитальном лечении 80 пациентов в отделении анестезиологии и реанимации БУЗ «ГКБ № 2» изучена динамика мазков крови, осмотической резистентности эритроцитов (ОРЭ) и состояния эритроцитов в кроваво-лекарственных смесях, при исследовании 30 взрослых добровольцев-доноров исследована гемостатическая активность, при исследовании консервированной донорской крови 10 доноров в условиях in vitro исследована текучесть (вязкость) крови и кроваво-лекарственных смесей и свертывающая активность плазмы, при исследовании физико-химических характеристик лекарств в условиях контрольно-аналитической лаборатории «Фармэкспертиза» и биохимических лабораторий в клиниках изучены контролируемые физико-химические показатели качества и неконтролируемые физико-химические характеристики качественных растворов для инъекций 18 лекарственных средств [3, 5].
Осмотическая резистентность эритроцитов (ОРЭ) определялась по общепринятой методике до и после взаимодействия in vitro крови пациента с раствором выбранного лекарственного средства в соотношении 1:1 при комнатной температуре на протяжении 1 и 3 минуты. Морфологическое состояние эритроцитов изучено при 1000-кратном иммерсионном увеличении с помощью микроскопа «ЛОМО-МИКМЕД-2» в мазках крови, приготовленных до и после смешивания in vitro в равных соотношениях порции венозной крови пациента с раствором выбранного лекарственного средства на протяжении 1 или 3 минуты при температуре +24 – +26 °С. Мазки крови готовили по стандартной методике и окрашивали по Романовскому-Гимзе. Диаметр эритроцитов измерялся с помощью микрометра МОВ-1-15х на микроскопе БИОЛАМ-ЛОМО при увеличении 40 нм. Кровь для исследования была взята из локтевой вены или из пальца руки.
Свертывающая активность плазмы исследовалась общим клиническим методом, гемостатическая активность крови исследовалась на взрослых добровольцах-донорах при нанесении им раны скарификатором в сочетании с методом Дьюка в модификации В.В. Меньшикова по описанной ранее методике [5]. Динамическая вязкость кроваво-лекарственных смесей определялась с помощью вискозиметра с падающим шариком (вискозиметра типа Гепплера) по времени падения шарика на дно специальной трубки. Осмотическая активность растворов лекарственных средств определялась криоскопически с помощью осмометра марки OSMOMAT-030 RS, кислотная активность лекарств определялась по паспортам лекарственных средств, выданных ОТК заводов-производителей лекарств, и по паспортам лекарственных средств, выданных контрольно-аналитической лабораторией. При выборе лекарственных средств предпочтение было отдано лекарствам, способным вызывать инъекционную болезнь кожи [33, 34]. Использованы следующие качественные растворы для инъекций: раствор 1 % димедрола, раствор 2 % папаверина гидрохлорида, раствор 1 % пиридоксина, раствор 5 % аскорбиновой кислоты, раствор 2,4 % и 24 % эуфиллина, раствор 10 % кальция хлорида, раствор 10 % лидокаина гидрохлорида, 20 % гексенала натрия, раствор 20 % цефаперазона натрия, раствор 20 % цефазолина натрия, раствор 20 % кофеина бензоата натрия, раствор 20 % или 40 % глюкозы, раствор 50 % анальгина, раствор 20 % магния сульфата, раствор 76 % урографина. В качестве безопасного лекарства использован раствор 0,9 % натрия хлорида.
Статистическая обработка результатов проведена с помощью программы BIOSTAT по общепринятой методике.
Результаты исследования и их обсуждение
Показано, что значения ОРЭ у всех пациентов отличаются друг от друга и от здоровых людей, и это отличие влияет на их устойчивость к лекарствам. Установлено, что все исследованные нами лекарства, за исключением раствора 0,9 % натрия хлорида, снижают ОРЭ тем сильнее, чем ниже эти значения ОРЭ были у пациентов до введения в кровь лекарственных средств.
Так, до и после 3-х минут взаимодействия крови пациентов с раствором 0,9 % натрия хлорида средние значения ОРЭ составляли соответственно 13,97 ± 4 % и 15,49 ± 4 % (Р<0, 05, n=10), то есть не имели достоверных отличий. В то же время, через 3 минуты взаимодействия крови с такими лекарствами, как раствор 1 % димедрола, раствор 2 % папаверина гидрохлорида, раствор 1 % пиридоксина, раствор 5 % аскорбиновой кислоты, раствор 2,4 % и 24 % эуфиллина, раствор 10 % кальция хлорида, раствор 10 % лидокаина гидрохлорида, 20 % гексенала натрия, раствор 20 % цефаперазона натрия, раствор 20 % цефазолина натрия, раствор 20 % кофеина бензоата натрия, раствор 20 % или 40 % глюкозы, раствор 50 % анальгина, раствор 20 % магния сульфата и раствор 76 % урографина, значения ОРЭ снижались в 2 – 27 раз.
Нами был проведен анализ полученных результатов, который показал, что значения ОРЭ наиболее значительно изменяют растворы с лекарственными средствами в концентрации выше 10 %. Демонстрацией этой закономерности может служить действие растворов 2, 4 % и 24 % эуфиллина. Так, через 3 минуты взаимодействия крови пациентов с раствором 2,4 % эуфиллина значения ОРЭ изменились с 8,4 ± 1,7 % до 27, 2 ± 5,36 % эритроцитов (Р < 0, 05, n = 23), то есть в 3 раза, а после взаимодействия с раствором 24 % эуфиллина значения ОРЭ изменились с 3, 6 ± 0, 9 % до 100 % эритроцитов, то есть в 27 раз.
Следовательно, растворы, содержащие лекарственные средства в концентрации выше 10 % при 3-минутном взаимодействии с кровью уменьшают осмотическую резистентность эритроцитов, причем растворы с очень высокой концентрацией лекарств могут уменьшить их осмотическую резистентность вплоть до нуля. В связи с этим предполагается, что усиление повреждающего действия лекарств на эритроциты при повышении концентрации лекарств в растворах обусловлено повышением их гиперосмотической активности.
Нами было изучено состояние мазков крови пациентов. Полученные при этом результаты показали, что эритроциты пациентов имеют симметричную дисковидную форму, а их диаметр в среднем равен 7,2 ± 1,3 мк (Р<0, 05, n=30), что соответствует физиологической норме. Через 1 и 3 минуты взаимодействия крови с раствором 0,9 % натрия хлорида in vitro все эритроциты в мазках, приготовленных из этой кроваво-лекарственной смеси, сохраняют правильную дисковидную форму и размер (рис. 1). В частности в наших опытах средний диаметр эритроцитов через 1 и 3 минуты взаимодействия с раствором 0,9 % натрия хлорида составил соответственно 7,4 ± 1, 2 и 7,7 ± 1,3 мк (Р<0, 05, n=30). Однако через 1–3 минут взаимодействия крови с растворами других лекарственных средств эритроциты повреждаются. Причем, повреждающее действие лекарств увеличивается по мере увеличения длительности взаимодействия с кровью и/или увеличения концентрации лекарственных средств в растворах. При этом растворы, содержащие лекарственные средства в концентрации более 10 % (в частности раствор 20 % гексенала натрия, раствор 20 % цефаперазона натрия, раствор 20 % цефазолина натрия, раствор 20 % кофеина бензоата натрия, раствор 20 % или 40 % глюкозы, раствор 50 % анальгина, раствор 20 % магния сульфата, раствор 76 % урографина.), сморщивают эритроциты. Красные кровяные клетки при этом приобретают форму шестеренок («зубчатых» кругов), как, например, под влиянием раствора 50 % анальгина (рис. 2).
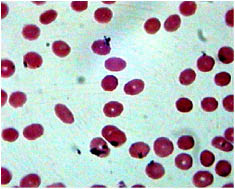
Рис. 1. Микропрепарат венозной крови пациента через 3 минуты взаимодействия с раствором 0,9 % натрия хлорида (контроль). Окраска Романовского-Гимзе, увеличение x 1000
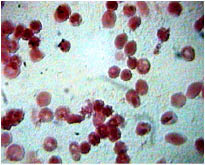
Рис. 2. Микропрепарат крови пациента через 3 минуты взаимодействия с раствором 50 % метамизола натрия. Окраска Романовского-Гимзе, увеличение x 1000
Такое изменение эритроцитов происходит, по-видимому, из-за обезвоживания, возникающего под влиянием их гиперосмотической активности лекарств.
С другой стороны, растворы лекарственных средств, обладающие высокой щелочной активностью (как например растворы эуфиллина и кальция хлорида), склеивают эритроциты друг с другом в цепочки (рис. 3).
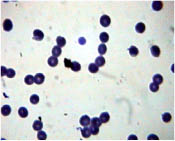
Рис. 3. Микропрепарат крови пациента через 3 минуты взаимодействия с раствором 10 % кальция хлорида. Окраска Романовского-Гимзе, увеличение x 1000
Через 3 минуты взаимодействия крови с раствором 2, 4 % эуфиллина в мазках кроваво-лекарственной смеси происходит увеличение размеров всех эритроцитов в диаметре в среднем до 9, 4±1, 3 мк (Р<0, 05, n=30) и у 43 ± 3, 9 % (Р<0, 05, n=30) эритроцитов выявляется анизоцитоз, а у 37 ± 2, 7 % (Р<0, 05, n=30) – эхиноцитоз. При этом также, как при действии кальция хлорида выявляется синдром сладжирования эритроцитов, который происходит с преобладанием цепочек, состоящих из 2–3-х эритроцитов.
Перечисленные изменения структуры эритроцитов возникают, вероятнее всего, из-за гипоосмотической и щелочной активности раствора 2,4 % эуфиллина.
Через 1 минуту взаимодействия крови с раствором 24 % эуфиллина в мазках кроваво-лекарственной смеси все эритроциты уменьшаются в диаметре до 4, 3±0, 3 мк (Р<0,05, n=30). При этом 79 ± 6,8 % (Р<0,05, n=30) эритроцитов имеют неправильную форму с просветлением в центре, с выраженной базофилией и с выраженной анизохромной реакцией, а 98 ± 9,9 % (Р<0,05, n=30) эритроцитов имеют анизоцитоз. Через 3 минуты взаимодействия крови с раствором 24 % эуфиллина в мазках кроваво-лекарственной смеси выявляются следующие изменения эритроцитов: все эритроциты уменьшаются в диаметре до 3,9 ± 0,1 мк (Р < 0,05, n = 30), анизоцитоз выявляется в 100 % эритроцитов, а соотношение эритроцитов, измененных по форме, достигает 87 ± 5, 9 % (Р < 0,05, n = 30).
Данные изменения возникают, вероятнее всего, из-за чрезмерно высокой гиперосмотической и гиперщелочной активности раствора 24 % эуфиллина.
Причем, почти все эритроциты оказываются склеенными в цепочки, включающие от 3 до 18 клеток, напоминая собой картину «сладж»-феномена, и почти все эритроциты имеют разрушенную плазмолемму (рис. 4).
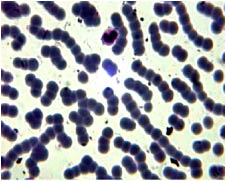
Рис. 4. Микропрепарат крови пациента после 3-минутного взаимодействия с раствором 24 % эуфиллина. Окраска Романовского-Гимзе, увеличение x 1000
В свою очередь, растворы 1 % димедрола (рН 5, 1), 2 % папаверина гидрохлорида (рН 2, 7) и другие «кислые» лекарства (например, раствор 1 % пиридоксина и раствор 5 % аскорбиновой кислоты) вызывают вакуализацию и дезагрегацию эритроцитов (рис. 5 и 6).
В частности, пиридоксин, аскорбиновая кислота, димедрол и папаверин вызывают набухание эритроцитов и образование в них «вакуолей», что в последующем приводит к дезагрегации эритроцитов. Так, через 3 минуты взаимодействия крови с раствором 1 % пиридоксина и 1 % димедрола количество «вакуолизированных» пойкилоцитов достигло 67 ± 7,1 % (Р<0, 05, n=30) и 98 ± 8,7 % (Р<0, 05, п=30) (соответственно). При этом диаметр эритроцитов увеличился до 13, 75 ± 0,4 мк (Р<0, 05, n=30). Данные изменения возникают, вероятно, из-за гипоосмотической активности препаратов.
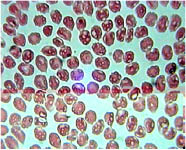
Рис. 5. Микропрепарат крови пациента после 3-минутного взаимодействия с раствором 1 % пиридоксина. Окраска Романовского-Гимзе, увеличение x 1000
Через 3 минуты взаимодействия крови с раствором 2 % папаверина гидрохлорида в 68 ± 5,8 % (Р<0, 05, n=30) эритроцитов выявляются гипохромность, гемолиз и дезагрегация. При этом 32 ± 3,4 % (Р<0, 05, n=30) эритроцитов уменьшила свои размеры, и величина их диаметра достигла 10,9±1,52 мк (Р<0, 05, n=30).
С другой стороны, при исследовании лабораторных анализов и функции крови у взрослых доноров после сдачи ими 250 мл крови показано, что после сдачи крови у доноров ухудшаются показатели здоровья крови, а именно – уменьшается содержание красных и белых клеток крови на 5–9 %, увеличивается время кровотечения и массивность кровопотери по Дьюку соответственно на 12–16 % и 2–3 %. Обнаружено, что последующее введение в вены этим донорам 250 мл 0, 9 % раствора хлорида натрия уменьшает содержание красных и белых клеток крови в анализах крови дополнительно еще на 7–14 % и дополнительно увеличивает время и массивность кровотечения соответственно на 25–30 % и 2-3 %. Последующее повторное введение донорам дополнительного объема раствора 0, 9 % натрия хлорида в объеме 250 мл уменьшает содержание форменных элементов крови еще на 5–8 % и увеличивает время кровотечения и массивность кровопотери еще на 10–12 % и 3 % соответственно. Вызванное инфузионным раствором снижение гемостатической активности крови сохранялось свыше двух часов.
Проведенное нами исследование свертывающей активности плазмы пациентов показало, что разведение плазмы раствором 0,9 % натрия хлорида или раствором 20 % глюкозы в соотношениях кровь/лекарство 5/1, 2/1 или 1/1 прогрессивно снижает коагулирующую активность плазмы в среднем на 20, 33 и 50 % (соответственно). Изучение вязкости донорской крови in vitro показало, что вязкость крови существенно изменяется при разведении ее растворами лекарственных средств в температурном диапазоне 0 – + 42 ºС. При этом нагревание консервированной донорской крови с +37 до +42 ºС не ведет к достоверному изменению вязкости, а охлаждение ее с +37 до +30 ºС ведет к достоверному повышению вязкости в среднем на 11 %. В то же время, введение в консервированную донорскую кровь растворов 0,9 % натрия хлорида или раствора 20 % глюкозы в соотношении 5/1 кровь/лекарство уменьшает вязкость крови на 20–30 % во всем исследованном нами диапазоне температур, включая диапазон +30 – +42 °С.
Иными словами, введение в кровь водных растворов лекарственных средств снижает ее вязкость и делает кровь более текучей при всех температурных режимах за счет разведения плазмы водой, являющейся формообразующим средством растворов для инъекций.
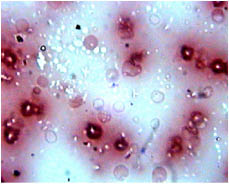
Рис 6. Микропрепарат крови пациента через 3 минуты взаимодействия с раствором 2 % папаверина гидрохлорида. Окраска Романовского-Гимзе, увеличение x 1000
Заключение. Таким образом, лекарства из таких фармакологических групп, как анестезирующие, психостимулирующие, противовоспалительные, спазмолитические, химиотерапевтические, витаминные, дегидратирующие, инфузионные и рентгеноконтрастные препараты, произведенные в лекарственной форме «Растворы для инъекций» и считающиеся сегодня высоко качественными, при введении в кровь разбавляют (разводят) ее водой (вода является формообразующим компонентом растворов для инъекций), ухудшают состав и анализ крови, разводят плазму, снижают гемостатическую активность крови и вызывают кислотное (реже щелочное) и осмотическое (гипотоническое или гипертоническое) повреждение эритроцитов. Указанные изменения возникают практически немедленно после введения лекарств в кровь и сохраняются в организме человека более 2-х часов.
Общий анализ крови при этом свидетельствует об анемии, измененная функция плазмы крови свидетельствует о наличии гипокоагуляционного синдрома, а поврежденная структура и функция эритроцитов свидетельствуют о наличии гемолитического синдрома. Указанная сумма лабораторных данных однозначно свидетельствует о том, что внутривенные инъекции современных высоко качественных растворов для инъекций вызывают болезнь крови. Поскольку эта болезнь крови до сих пор не была известна и не была ранее описана, предлагается дать ей следующее название – «Инъекционная болезнь крови».
Инъекционная болезнь крови возникает от того, что современные растворы лекарственных средств представляют собой водные растворы солей, введение которых в кровь моделирует ее отек, разбавляет плазму, разводит кровь и уменьшает содержание клеток крови. Это нарушает функцию крови и ее плазмы (ухудшает свертывающую активность плазмы, вязкость, гемостатическую, газообменную, питательную и защитную функцию крови). Кроме этого, большинство современных растворов для инъекций имеет чрезмерно высокую кислотность (или щелочность) при одновременной чрезмерно низкой или высокой осмотической активности. Поэтому лекарства вызывают соответственно кислотную или щелочную денатурацию белков плазмы и водное или обезвоживающее повреждение клеток крови (в первую очередь, эритроцитов), что ведет к их дезагрегации и гемолизу.
Библиографическая ссылка
Ураков А.Л. ВНУТРИВЕННОЕ ВВЕДЕНИЕ КАЧЕСТВЕННЫХ «РАСТВОРОВ ДЛЯ ИНЪЕКЦИЙ» ВЫЗЫВАЕТ ИНЪЕКЦИОННУЮ БОЛЕЗНЬ КРОВИ // Международный журнал экспериментального образования. 2013. № 11-2. С. 66-71;URL: https://expeducation.ru/ru/article/view?id=4318 (дата обращения: 07.01.2026).

