Природными полиацетиленами принято называть соединения, содержащие в своей структуре две или более тройные связи. В широком смысле ацетиленовые соединения включают все вещества с углерод-углеродной тройной связью или алкинильной функциональной группой.
Термин «полиацетилены», часто используемый в научной литературе для этого класса природных веществ, не соответствует номенклатуре органических соединений, поскольку эти соединения не являются полимерами, а некоторые из них содержат только одну ацетиленовую связь. В научной литературе нет единого подхода к их названию, но чаще всего используются исторически закрепившиеся термины – полиацетилены, ацетилены или полиины.
Соединения, содержащие тройные связи, также как и другие ненасыщенные органические вещества, являются химически и биологически активными [5, 9]. Высокая реакционная способность, приводящая к быстрому окислению и деградации этих соединений, особенно при воздействии УФ-света, кислорода воздуха, рН-среды и других факторов позволяет характеризовать их как относительно нестабильные, требующие особых условий выделения и исследования.
Ацетилены широко распространены в природе. Они обнаружены в высших растениях, мхах, лишайниках, грибах, микроорганизмах, морских водорослях, губках, оболочниках, насекомых, лягушках [6, 7, 8]. В следовых количествах найдены у млекопитающих, в том числе и у человека (Lindstedt, Steen, 1975). Полиацетилены наиболее часто встречаются в семи семействах высших растений: Apiaceae, Araliaceae, Asteraceae, Campanulaceae, Olacaceae, Pittosporaceae и Santalaceae. Спорадически обнаруживаются ещё в семнадцати растительных семействах [1, 6, 7]. Содержание ацетиленов в разных растениях, их частях и органах может колебаться от 10-6 % до 1 % в пересчёте на свежее сырьё [6]. Более 2000 полиацетиленов известны сегодня, из них более 1100 обнаружены в растениях сем. Asteraceae.
Первоначально за этим классом природных соединений закрепилась слава очень сильных растительных ядов. Некоторые из них были идентифицированы, как пигменты растений, накапливающиеся в цветках и корнях. Многие полиацетилены обнаружены в составе эфирных масел растений и это подтверждает их ярко выраженные экологические функции [3].
Во взаимоотношениях с насекомыми полиацетилены растений могут выполнять различные функции [5]. Так, например, ароматический полиацетилен, обнаруженный в Coreopsis tinctoria Nutt., является основным хромофором цветков, привлекающим определенную группу насекомых-опылителей (Гольмов, Афанасьев, 1958). Однако эти вещества могут быть использованы растением и для защиты от некоторых видов энтомофауны. Более специализированный способ защиты растений от насекомых состоит в образовании на поверхности листьев железистых волосков или трихом, в которых концентрируются данные соединения. Токсины трихом могут высвобождаться в тот момент, когда насекомое садится на растение или начинает его повреждать. В обоих случаях это предотвращает обгрызание растения насекомым (Харборн, 1985). Пример тому – инсектицидные свойства капиллена и капиллина [3]. Эти вещества содержатся в эндогенных и экзогенных секреторных образованиях некоторых видов полыней (Artemisia sp.).
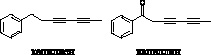
Фенилгептатриин – полиацетилен, обнаруженный в различных видах сем. Asteraceae, проявлял антифидантные свойства (при концентрациях 10-300 частей на миллион) в отношении личинок Euxoa messoria (McLachlan et al., 1982).
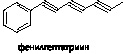
Были идентифицированы девять полиацетиленов в Chrysanthemum coronarium, из которых четыре ингибировали активность ювенильных гормонов Oncopeltus fasciatus (Song et al., 2005).
Инсектицидная активность в отношении Spodoptera littoralis caterpillars обнаружена у спирокетальенольного полиацетилена, выделенного из листьев Chrysanthemum macrotum (Haouas et al., 2011).
Токсичность полиацетиленовых соединений в отношении насекомых, по мнению некоторых исследователей, может быть обусловлена различными механизмами. При отсутствии света полиацетилены – антифиданты насекомых (Champagne et al., 1986). При освещении некоторые полиацетилены проявляют инсектицидную активность. Известны две гипотезы, объясняющие эту особенность.
Первая связана с их способностью активировать фотокаталитический цикл производства синглетного кислорода, что приводит к быстрому перекисному окислению липидов и некрозу клеток (Champagne et al.,1986). Вторая – с фотогенотоксичностью этих соединений. Они взаимодействуют с ДНК и при коротковолновом УФ-свете образуют моно- и бифункциональные аддукты с основаниями пиримидина (Arnason, Bernards, 2010).
Некоторые полиацетилены, такие как относительно устойчивые фенилгептатриин и альфа-треттиенил фототоксичны для насекомых и грибов при очень низких концентрациях (Downum, 1992).
![]()
Фототоксические свойства полиинов исследовались на личинках отдельных насекомых. Активность тиарубрина С (1), тиофена (2) и полиацетилена с пятью сопряженными тройными связями (3), выделенными из Rudbeckia hirta, была исследована в различных областях УФ-излучения и в темноте (Guillet et al., 1997). В темноте тиарубрин С (1) токсичен к личинкам москита (Aedes atropalpus, LC50 = 0.09 мкг/мл) и табачного бражника Manduca sexta (62 % личинок гибли при концентрации 50 мкг/мл).
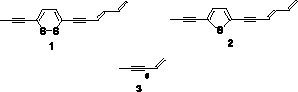
Рис. 1. Полиацетилены Rudbeckia hirta
Тиофен (2) проявил токсичность к личинкам A. atropalpus в коротковолновом диапазоне УФ-излучения, а полиацетилен 3 был токсичен при всех состояниях. Изменчивость инсектицидной фотоактивности, по всей видимости, характеризует разные механизмы её проявления.
В ограниченном ряде случаев, ацетилены растений действуют как алломоны (то есть, транс-специфические химические сигналы, индуцирующие изменение поведения других видов в выгодном направлении для продуцирующего их вида). Жуки Chauliognathus sp. накапливают дигидроматрикариевую кислоту в гемолимфе и могут выделять её из сегментальных желез (Meinwald et al.,1968).
![]()
Это соединение, являясь антифидантом, защищает их от уничтожения сойками, мышами и муравьями.
Соединение 3 (тридек-1-ен-3,5,7,9,11-пентаин на рис. 3) – первое из нематодоцидных ацетиленов, идентифицированное F.J. Gommers (1973) в видах рода Helenium. Позже тиарубрин C (соединение 1 на рис. 3) был выделен из корней рудбекии (Rudbeckia hirta). LC50 в отношении Meloidogyne incognita составила 12,4 мкг/мл и 23,5 мкг/мл для Pratylenchus penetrans (Sanchez de Viala et al., 1998). Свет увеличивал нематодоцидную активность. Обработка почвы тиарубрином C (50 мкг/мл) снижала поражение томатов
M. incognita почти на 95 %.
Нематодотоксичность некоторых полиацетиленов, обнаруженных в видах сем. Asteraceae, проявляется уже при концентрации 1,0 мкг/мл. В эксперименте с 28 синтетическими ацетиленами в отношении Pratylenchus coffeae было установлено, что активность была самой большой
(<1,0 мкг/мл), когда тройная связь была сопряжена со сложноэфирной, кетонной или ароматической углеводородной функциональной группой [2.
В ходе борьбы за существование высшие растения конкурируют между собой в экосистемах за влагу, свет и питательные вещества почвы. Из вторичных веществ применительно к аллелопатии рассматривали в основном терпены (моно- и сескви-) и фенольные соединения (фенолы, фенольные кислоты, транс-коричную кислоту и ее производные, гидроксихиноны) (Харборн, 1985). Современные исследования по этому вопросу показывают, что в аллелопатических взаимодействиях активную роль могут играть и полиацетилены. У некоторых кустарниковых и травянистых представителей сем. Asteraceae выделяются полиацетилены, которые, попадая в почву, подавляют рост соседних видов. Так, ароматический полиацетиленовый углеводород – капиллен, обнаруженный в полыни волосовидной (Artemisia capillaris), ингибирует прорастание семян проса, капусты, моркови, Viola tricolor L. при концентрации в почве 1.23 мг/см2 [2].
Acroptilon repens (Centaurea repens), представитель сем. Asteraceae, является одним из самых агрессивных и экологически угрожающих сорных видов на западе Северной Америки. Как большинство инвазивных видов, A. repens, прежде всего, распространяется в нарушенных экосистемах. Каждый год его ареал в Северной Америке расширяется приблизительно на 8 %. Управляемое биопробой фракционирование экстрактов корня этого растения привело к выделению пяти полиацетиленовых тиофенов (Quintana et al., 2008).
Соединения 1, 3-5 (см. рис. 2)обладали фитотоксической активностью в отношении сеянцев Arabidopsis thaliana. Соединение 1 оказалось самым активным и в отличие от других тестировавшихся полиацетиленов содержало хлор в составе терминального группы. Его структурный изомер – соединение 2 было неактивным. По мнению авторов исследования, разное положение гидроксила (-ОН) и атома хлора (Cl-) в обеих молекулах может играть важную роль в их способности ингибировать рост других растительных видов.
У биосинтетически близкого к ароматическим полиацетиленам изокумарина капилларина установлена эстрогенная активность [4].
Тиофен, выделенный из корней Centaurea repens, обнаруживается в почве в концентрации 4-5⋅10-6 %, которая, тем не менее, достаточна для ингибирования удлинения корня и подавления роста конкурирующих видов (Stevens, 1986).
![]()
Более токсичный агроцибин активно подавляет рост проростков пшеницы, сои и Lemna minor, вызывая гибель растений, так называемыми, «ведьмиными кольцами» (Ayer, Craw, 1989).
![]()
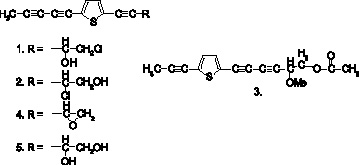
Рис. 2. Полиацетилены Acroptilon repens
Дегидрофалькаринол был идентифицирован в корнях Artemisia capillaris, как один из компонентов, ингибирующих прорастание семян (Ishizu et al., 1999).
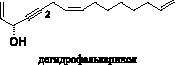
Большинство исследований показывают, что полиацетилены накапливаются во внешних тканях различных органов растений, выполняя защитную функцию. Так в корнях Panax quinquefolium содержание панаксидола и фалькаринола в эпидерме корня обратно пропорционально коррелирует с его диаметром (Christensen et al., 2006). Локализация полиацетиленов во внешних слоях корня совместима с их ролью противогрибкового щита, особенно для молодых растений.
Как известно, многие полиацетилены являются фитоалексинами – низкомолекулярными веществами, синтезируемыми растениями в ответ на микробное воздействие, состояние болезни или абиотический стресс (например, УФ-излучение, соли металлов, детергенты) (Ebel, 1986).
Фалькаринол и фалькариндиол идентифицированы как противогрибковые вещества во многих видах растений сем. Apiaceae и в экспериментах ингибировали прорастание спор различных грибов в концентрациях 20-200 мкг/мл [7].
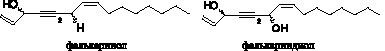
Представители семейства паслёновых (Solanaceae) и лавровых (Lauraceae) синтезируют полиацетилены de novo в ответ на микробную инфекцию, но в нормальных условиях их не производят. Так при заражении плодов и листьев томатов листовой плесенью (Cladosporium fulvum), они начинают синтезировать ацетиленовые фитоалексины: фалькаринол и фалькариндиол (De Wit, Kodde, 1981).
Эти вещества также обнаружены в растениях томатов зараженных Verticillium alboatrum (Elgersma et al., 1984). Баклажаны (Solanaceae) показали способность синтезировать фалькариндиол и полиаце-
тилен
![]()
при воздействии некоторых элиситоров (Imoto, Ohta, 1988).
Антракноз авокадо (Persea americana, Lauraceae), вызванный грибом Colletotrichum gloeosporioides, является главным фактором порчи его плодов. Развитие этого эндофитного гриба подавляется полиацетиленовыми фитоалексинами, синтезируемыми пораженными растениями (Oberlies et al., 1998).
![]()
Производство ацетиленов, как ответная реакция на воздействие грибных элиситоров, обнаружено в видах растений сем. Fabaceae.
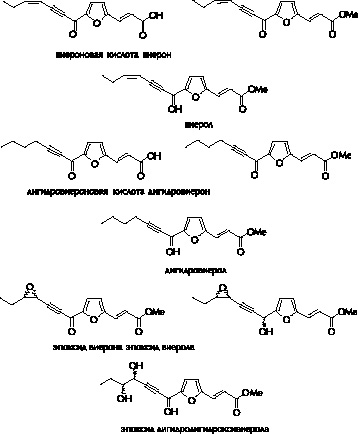
Рис. 3. Фураноацетилены, выделенные из конских бобов (Vicia faba) и чечевицы (Lens culinaris), инфицированных Botrytis spp.
Стимуляция биосинтеза полиацетиленов элиситорами грибов была замечена и в других растительных семействах. Так сафинол накапливался в Carthamus tinctorius сем. Asteraceae при воздействии элиситоров Phytophthora drechsleri (Tietjen, Matern, 1984), виерон в Vicia faba сем. Fabaceae (Nawar, Kuti, 2003), а фалькаринол и фалькариндиол в Daucus carota сем. Apiaceae обнаруживались в тканях растений инфицированных Botrytis cinerea (Harding, Heale, 1981).
Взаимосвязь структуры и активности 12 ацетиленов и их производных, выделенных из галлов Hedera rhombea (Araliaceae), образованных Asphondylia sp. (Cecidomyiidae), исследовалась на модели ингибирования роста побегов и корней петушиного гребня (Celosia argentea L.), салата (Lactuca sativa L.), кресса (Lepidium sativum L.), риса (Oryza sativa L.) и многолетнего плевела (Lolium perenne L.). Диацетилены показали более высокую активность, чем моноацетилены. Ацетилены с неокисленной метиленовой группой при C-8 оказались активнее в сравнении с гидрокси- и ацетоксипроизводными. Кроме того, было продемонстрировано, что наличие терминальной олефиновой группу при C-16, C-17 существенно повышает ингибирующие свойства соединений (Yamazoe et al., 2006).
Таким образом, полиацетиленовые соединения – важный фактор химической экологии высших растений. В системах взаимоотношений растение-растение, растение-насекомое, растение-микроорганизм эти соединения проявляют в широком смысле защитные и адаптивные функции.
Библиографическая ссылка
Коновалов Д.А., Оробинская В.Н. ПОЛИАЦЕТИЛЕНОВЫЕ СОЕДИНЕНИЯ КАК ФАКТОР ХИМИЧЕСКОЙ ЭКОЛОГИИ ЛЕКАРСТВЕННЫХ РАСТЕНИЙ // Международный журнал экспериментального образования. 2013. № 11-3. С. 180-185;URL: https://expeducation.ru/ru/article/view?id=4339 (дата обращения: 14.12.2025).

