Введение
Изучение проблемы воспалительных заболеваний женских половых органов является важной, поскольку 60-65 % всех больных восходящими инфекциями малого таза - пациентки с воспалениями гениталий [21-23,25,30]. Понятие воспалительных заболеваний женских половых органов является собирательным [31]. В него входят различные нозологические формы, в этиологии которых ведущую роль часто играют возбудители инфекций, передаваемых половым путем (ИППП) Однако, накопленные данные мировой литературы свидетельствуют о том, что помимо вышеуказанных возбудителей в этиологии воспалительных заболеваний гениталий у женщин играют роль и микроорганизмы, относящиеся к условно-патогенной флоре [1,4,27,29]. По данным литературы, микроорганизмы условно-патогенного ряда часто являются этиологическим началом неспецифической инфекции во влагалище у женщин различных периодов жизни [23,26], но в то же время многие виды бактерий являются труднокультивируемыми [2, 9,12,17,20]. Поэтому вопрос выделения из половых путей облигатных и строгих анаэробных видов микроорганизмов является актуальным по настоящее время, а вопросы усовершенствования диагностики вагинальных инфекций являются приоритетными. Отсутствие стандартизованных подходов в диагностике инфекций влагалища и недостаточно разработанной лабораторной верификации условно-патогенных микроорганизмов (УПМ), приводит к разноречивым заключениям при установлении точного диагноза вульвовагинальной инфекции [10,17-19]. Существующие Клинические рекомендации не содержат четких указаний по использованию перечня методов исследования, т.е. альтернативных или дополнительных к бактериологическому методу, служащих для идентификации условно-патогенных микроорганизмов при диагностике инфекций влагалища [13]. Широко применяемые способы диагностики, такие как критерии Amsel (1983) и критерии Nugent (1991), для оценки инфекционного процесса во влагалище, основаны на отдельных признаках клинико-микроскопической картины заболевания [24,28]. Существенным недостатком при использовании перечисленных критериев является отсутствие видовой идентификации микроорганизмов. Формальными недостатками применяемых способов диагностики, являются множество методик обследования, расхождения в понимании этиологии и патогенеза неспецифических инфекционно-воспалительных процессов во влагалище у женщин, обусловленных УПМ, что затрудняет дифференциальную диагностику заболеваний этой группы [11,13,17,21].
Цель исследования: оценка диагностической значимости методов верификации инфекционной вульвовагинальной патологии.
Материалы и методы
В клинике института проведено клинико-лабораторное обследование 107 женщин в возрасте от 18 до 45 лет (средний возраст 28±10) с неустановленным диагнозом вагинальной инфекции (Диагноз сомнительный), предъявляющих жалобы на выделения из половых путей при полном исключении инфекций, передаваемых половым путем. Материалом для лабораторного исследования служил соскоб эпителиальных клеток заднебокового свода влагалища. Для выявления этиологического фактора вагинальной инфекции, нами предложено использование методов ПЦР в режиме реального времени и метода бактериологического посева вагинального отделяемого. Используемое для дифференциальной диагностики оборудование и наборы реагентов разрешены к применению в медицинской практике и внесены в Государственный реестр изделий медицинского назначения и медицинской техники: микроскопы биологические (операционные) Leica, производства (Швейцария), амплификатор детектирующий: ДТ-96, производства (Россия); набор реагентов для исследования биоценоза урогенитального тракта у женщин методом ПЦР в режиме реального времени в комплектации: Фемофлор-16, производства (Россия), диагностическая тест-система позволяющая определить наличие более 25 видов представителей условно-патогенной микрофлоры, основана на выявлении этиологической структуры и родовидовой характеристики спектра микроорганизмов, присутствующих в вагинальной микрофлоре [2,3]; бактериологический метод посева на питательные среды (агар с добавлением 5,0 % донорской крови, агар Сабуро др.), видовую идентификацию микроорганизмов проводили общепринятыми методами. Забор клинического материала для проведения дифференциальной диагностики и уточнения диагноза у каждой женщины проводили параллельно по результатам клинической картины и двум методам обследования (ПЦР в режиме реального времени и бактериологического посева).
Статистическая обработка полученных данных проводилась с использованием параметрических и непараметрических методов анализа с использованием пакета прикладной программы BioStat 2009 на основе использования методов доказательной медицины.
Результаты и обсуждение
Путем сравнительной оценки были сопоставлены диагностические результаты микробного спектра вагинального отделяемого, полученные при параллельном обследовании методом PCR real-time и бактериологическим методом. Согласно данным, представленным в таблице 1.
Таблица 1
Результаты микробного спектра клинического материала отделяемого половых путей (поливариантный признак)
|
Род, вид микроорганизма |
Удельный вес выделенных микроорганизмов |
Δ |
|||
|
PCR real-time n=107 |
Бактериологическое исследование n=107 |
||||
|
Абс. |
%±s |
Абс. |
%±s |
Абс. |
|
|
Lactobacillus spp |
102 |
95,3±0,3 |
60 |
56,1±1,0 |
+42 |
|
Streptococcus spp. |
18 |
50,0±0,7 |
4 |
3,7±0,4 |
+14 |
|
Staphylococcus spp., |
17 |
47,2±0,7 |
31 |
29,0±0,9 |
-14 |
|
Staphylococcus aureus |
- |
- |
8 |
7,5±0,5 |
-8 |
|
Enterococcus spp. |
- |
- |
5 |
4,7±0,4 |
-5 |
|
Escherichia coli |
12 |
33,3±0,6 |
15 |
15,9±0,7 |
-3 |
|
Klebsiella spp |
- |
- |
1 |
0,9±0,2 |
-1 |
|
Proteus spp. |
- |
- |
3 |
2,8±0,3 |
-3 |
|
Gardnerella vaginalis |
44 |
72,1±0,9 |
35 |
32,7±0,9 |
+9 |
|
Prevotella bivia |
34 |
72,1±0,9 |
- |
- |
+34 |
|
Porphyromonas spp; |
40 |
65,6±0,9 |
- |
- |
+40 |
|
Atopobium vaginae; |
71 |
77,2±0,8 |
- |
- |
+71 |
|
Eubacterium spp; |
51 |
83,6±0,9 |
- |
- |
+51 |
|
Sneathia spp |
32 |
52,5±0,9 |
- |
- |
+32 |
|
Leptotrihia spp |
32 |
52,5±0,9 |
- |
- |
+32 |
|
Fusobacterium spp; |
34 |
55,7±0,9 |
- |
- |
+34 |
|
Megasphera spp |
40 |
65,6±0,9 |
- |
- |
+40 |
|
Veilonella spp |
40 |
65,6±0,9 |
- |
- |
+40 |
|
Dialister spp |
40 |
65,6±0,9 |
- |
- |
+40 |
|
Lachnobacterium spp |
34 |
55,7±0,9 |
- |
- |
+34 |
|
Clostridium spp; |
34 |
55,7±0,9 |
- |
- |
+34 |
|
Mobiluncus spp |
32 |
52,5±0,9 |
- |
- |
+32 |
|
Corynebacterium spp; |
32 |
52,5±0,9 |
28 |
26,2±0,8 |
+4 |
|
Peptostreptococcus spp |
39 |
63,9±0,9 |
- |
- |
+39 |
|
Candida spp |
18 |
50,0±0,7 |
18 |
17,8±0,7 |
- |
|
Mycoplasma hominis |
44 |
72,1±0,9 |
15 |
15,9±0,7 |
+29 |
|
Ureaplasma urealyticum |
51 |
83,6±0,9 |
28 |
26,2±0,8 |
+23 |
Примечание: s – стандартная ошибка доли при р≤0,05; Δ – расхождения по абсолютному значению при р≤0,05: (-) – отрицательное значение в пользу бактериологического метода, (+) – положительное значение в пользу PCR real-time.
При верификации микробиоты влагалища показал более высокую прогностическую значимость, в качестве выделения условно-патогенных микроорганизмов, особенно строгих, облигатных анаэробов и микроаэрофиллов в высоком количественном титре - метод PCR real-time по сравнению с бактериологическим методом исследования (р≤0,05). Результат выявления Mycoplasma hominis и Ureaplasma urealyticum методом PCR real-time (р≤0,05) также был отличен от результатов, полученных бактериологическим методом (M. hominis ПЦР - 72,1 % против бактериологического метода - 15,9 % и U. urealyticum ПЦР - 83,6 % против бактериологического метода - 26,2 %). Данные по выявлению Candida spp не показали статистически значимых различий (р>0,05). Таким образом, молекулярно-генетический метод ПЦР в режиме реального времени позволил идентифицировать труднокультивируемые микроорганизмы до вида и определил их количественное содержание, следовательно, он может претендовать на альтернативное направление в исследовании условно-патогенных микроорганизмов, для ранней диагностики инфекционного процесса во влагалище.
В соответствии с этиологической причиной, полученные данные, следует интерпретировать следующим образом:
- наличие преимущественно строгих и/или облигатных анаэробов, микроаэрофиллов (Gardnerella vaginalis /Prevotella bivia/ Porphyromonas spp; Atopobium vaginae; Eubacterium spp; Sneathia spp /Leptotrihia spp/Fusobacterium spp; Megasphera spp/Veilonella spp/Dialister spp; Lachnobacterium spp/Clostridium spp; Mobiluncus spp/Corynebacterium spp; Peptostreptococcus spp), соответствует диагнозу: Бактериальный вагиноз.
- наличие преимущественно факультативных анаэробов и факультативных аэробов семейства Enterobacteraceae (Escherichia соli, Klebsiella spp., Proteus vulgaris), Streptococcus spp. и Staphylococcus spp., Enterococcus spp., соответствует диагнозу: Аэробный вагинит.
- наличие Candida spp.в абсолютном показателе >104 является диагностически значимым уровнем и соответствует диагнозу: Кандидоз вульвы и влагалища.
- наличие Mycoplasma hominis в абсолютном показателе >104 является диагностически значимым уровнем и соответствует диагнозу: Микоплазменная инфекция.
- наличие Ureaplasma urealyticum в абсолютном показателе >104 является диагностически значимым уровнем и соответствует диагнозу: Уреаплазменная инфекция.
Для доказательства эпизодов заключительного диагноза была проведена сравнительная оценка полученных данных и сопоставлены данные клинический диагноз - метод PCR real-time и клинический диагноз - бактериологический метод (табл.2).
Таблица 2
Сравнительная оценка заключительного диагноза вагинальной инфекции, подтвержденного с помощью методов PCR real-time и бактериологического исследования*
|
Заключительный диагноз |
Сравниваемые методы диагностики |
Δ |
|
|
ПЦР в режиме реального времени n=107 |
бактериологическое исследование n=107 |
||
|
Бактериальный вагиноз |
67 |
35 |
+32 |
|
Аэробный вагинит |
18 |
72 |
-54 |
|
Кандидоз вульвы и влагалища |
5 |
18 |
-13 |
|
Микоплазменная инфекция |
44 |
15 |
+29 |
|
Уреаплазменная инфекция |
51 |
28 |
+23 |
Примечание: * – диагноз установлен с учетом значимости количественного присутствия микроорганизма, ассоциаций микроорганизмов, признак расценивается как поливариантный; Δ – как в табл.1.
Таким образом, бактериологический метод диагностики проявил себя в качестве идентификации преимущественно аэробных микроорганизмов и дрожжеподобных грибов рода Candida, а метод ПЦР в режиме реального времени показал наиболее широкий диапазон верификации микроорганизмов, особенно труднокультивируемых. Данный факт позволяет применять методику PCR real-time для дифференцирования ранних стадий формирования дисбаланса микрофлоры половых путей женщины, помогает прогнозировать развитие инфекционного процесса, способствует минимизации затрат на диагностику и в дальнейшем способствует оптимизации терапии. Достоинством широкого внедрения метода ПЦР в режиме реального времени следует отметить сокращение времени диагностики вагинальной инфекции до одних суток (от взятия материала до установления диагноза), в сравнении с применением бактериологических методик – не менее 72 часов, а также его воспроизводимость в условиях амбулаторно-поликлинического приема.
На основании вышеизложенного, данных ранее опубликованных собственных исследований [7,8,5], включая патенты на изобретения [14,16,15], в клинике ФГБУ «Уральского НИИ дерматовенерологии и иммунопатологии» Минздрава России разработан алгоритм диагностики инфекций влагалища на основании клинико-лабораторной верификации топического и этиологического диагноза (рис.1).
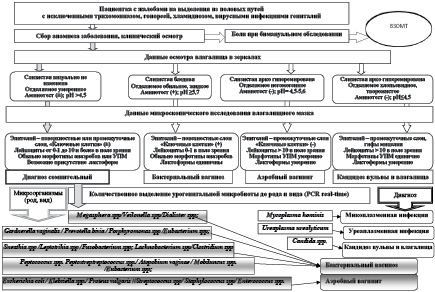
Рис. 1. Алгоритм клинико-лабораторной верификации топического и этиологического диагноза инфекционной вульвовагинальной этиологии
Первым этапом действий врача является сбор анамнеза и жалоб, клинический осмотр пациентки, проведение рН вагинального отделяемого, постановку аминопробы, забор материала для микроскопического исследования. В случае выявления болезненности при бимануальном исследовании, женщины обследуются и наблюдаются у акушера-гинеколога по протоколу восходящей инфекции малого таза. Пациентки без болевого синдрома, продолжают наблюдаться у дерматовенеролога или у акушера-гинеколога, им проводится обязательное микроскопическое исследование отделяемого половых путей и обследование на основные виды инфекций, передаваемых половым путем. При подтверждении инфекции, передаваемой половым путем, проводится ведение по протоколу и лечение в соответствии с разработанными стандартами. Сопоставление совокупности полученных клинических и лабораторных данных у пациентов без ИППП позволяет врачу диагностировать следующие вагинальные инфекции:
- Бактериальный вагиноз (код МКБ-X N89.8), если слизистая влагалища бледная, отделяемое обильное, жидкое, аминотест чаще положительный, рН ≥ 5,7, в мазке эпителий – поверхностные слои, «ключевые клетки» более 25 %, лейкоциты 0-1 в поле зрения, обильно присутствуют морфотипы анаэробов, лактоформы единичны;
- Аэробный вагинит (код МКБ-X N76.0 и N76.1), если слизистая влагалища ярко гиперемирована, отделяемое негомогенное, аминотест всегда отрицателен, рН = 4,5-5,6, в мазке эпителий – промежуточные слои, «ключевые клетки» отсутствуют, лейкоциты более 10 в поле зрения, морфотипы УПМ умеренно, лактоформы умеренно;
- Кандидоз вульвы или влагалища (код МКБ-X В37.3 при N77.1), если слизистая вульвы и/или влагалища ярко гиперемирована, отделяемое белое, хлопьевидное или творожистое, аминотест всегда отрицательный; рН≤4,5; в мазке - эпителий – промежуточные слои, гифы мицелия в большом количестве, лейкоциты более 10 в поле зрения, морфотипы УПМ единичны, лактоформы умеренно;
- «Диагноз сомнительный», слизистая вульвы и влагалища визуально не изменена, отделяемое умеренное, аминотест может быть сомнителен; рН > 4,5; в мазке - эпителий поверхностных или промежуточных слоёв, «ключевые клетки» присутствуют до 25 %, лейкоциты от 0-1 до 10 в поле зрения, обильно морфотипы анаэробов или УПМ, возможно присутствие лактоформ.
В случае «сомнительного диагноза», для уточнения этиологии инфекционного процесса предложен выбор молекулярно-биологического метода PCR real-time перед бактериологическим методом верификации диагноза в пользу качественной этиологической детализации видового состава микрофлоры влагалища, и дифференциального подхода к диагностике инфекций влагалища, обусловленных условно-патогенными микроорганизмами.
Выводы
1. Проведенное комплексное клинико-лабораторное обследование 107 пациенток с вульвовагинальной патологией, позволило, путем сравнения результативности установленных диагнозов вагинальной инфекции, подтвержденных молекулярно-генетическим (PCR real-time) и бактериологическим методами исследования, диагностировать бактериальный вагиноз у 67 и 35 больных, аэробный вагинит у 18 и 72 больных, кандидоз вульвы и влагалища у 5 и 18 больных, микоплазменная инфекция у 44 и 25 больных, уреаплазменная инфекция у 51 и 28 больных, соответственно.
2. Использование алгоритма позволяет повысить эффективность ранней дифференциальной диагностики, обеспечивает своевременное установление точного диагноза и выбор тактики назначения лечения, что способствует снижению риска развития осложнений и минимизации материальных затрат на дорогостоящие лабораторные исследования и лекарственные препараты.
Библиографическая ссылка
Воронова О.А., Зильберберг Н.В., Евстигнеева Н.П., Игликов В.А., Ковальчук И.А. АЛГОРИТМЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ИНФЕКЦИЙ, ПЕРЕДАВАЕМЫХ ПОЛОВЫМ ПУТЕМ, ОСНОВАННЫЕ НА ОЦЕНКЕ ДИАГНОСТИЧЕСКОЙ ЗНАЧИМОСТИ МЕТОДОВ ВЕРИФИКАЦИИ ИНФЕКЦИОННОЙ ВУЛЬВОВАГИНАЛЬНОЙ ПАТОЛОГИИ // Международный журнал экспериментального образования. 2014. № 1-2. С. 59-64;URL: https://expeducation.ru/ru/article/view?id=4557 (дата обращения: 02.03.2026).

