В литературе последних десятилетий неоднократно указывалось на ухудшение здоровья населения страны. Эта тенденция ярко проявляется еще на стадии раннего детства и подросткового периода [3]. Частным примером этого служат распространенные случаи функциональной задержки пубертата (ФЗПР), которая является следствием нарушений запуска триггеров импульсной секреции гонадотропинов полиэтиологической природы. Одной из причин ФЗПР рассматривают соматогенную «задержку» алиментарной природы (дефицит белка, микроэлементов и др.), или – влияние негативных психосоциальных факторов [4, 15. По данным И.И. Дедова и др.2002 [до 5 % детей в популяции имеют задержку пубертата, то есть у них недостаточно выражены признаки полового созревания к 13-14 годам.
Важной для раскрытия этиологии ФЗПР является информация о содержании химических элементов (ХЭ) в биосубстратах организма. Так, например, общеизвестна важная роль некоторых эссенциальных ХЭ (цинк, селен, хром) в становлении репродуктивной функции мужчин, марганца, меди – у женщин [12]. В то же время влияние токсичных ХЭ (свинец, кадмий, ртуть и др.) детерминирует полиморфные нарушения репродукции и онтогенеза [11].
Роль цинка, как одного из эссенциальных ХЭ, в физиологии онтогенеза млекопитающих уже подробно изучена [1]. Он участвует в нуклеиновом обмене, стабилизации уровня белков, необходим для формирования структур ДНК и РНК, рибосом, входя в состав РНК-синтаз [25]. Для клиники важно изучение последствий цинкдефицитных состояний, их ранняя диагностика, поскольку установлена прямая корреляция между пониженной активностью цинкзависимых ферментов (около 200), сниженным содержанием этого ХЭ в тканях и симптомами его недостаточности. Наиболее яркие из последних – отставания в развитии первичных и вторичных половых признаков, угнетение сперматогенеза, функции простаты, снижение когнитивных способностей, лимфопения и, как следствие, иммунодефицит [18, 23].
В то же время, несмотря на известную роль цинка в обеспечении нормального онтогенеза, симптомы его субклинического дефицита изучены недостаточно. Эта проблема, помимо медицинского, имеет социальное значение. Показано, что при его дефиците в организме прогрессирует предрасположенность к алкоголизму, особенно у подростков. Это связано с тем, что его недостаток способствует замедлению метаболизма этанола в организме, тем самым потенцируя процессы поражения печени [12].
По мнению указанных авторов [12] потребность цинка с пищей в России удовлетворяется лишь на 60-70 % от суточной оптимальной нормы потребления. При накоплении в организме его антагонистов (свинец, кадмий) ассоциированные патогенные проявления его дефицита возрастают, негативно отражаясь на его фенотипической адаптации.
В связи с этим обстоятельством на наш взгляд, возможно рассматривать ФЗПР как одно из проявлений дисбаланса физиологических эффектов ХЭ-антагонистов (микроэлементоз).
Как известно, одним из наиболее физиологических антагонистов цинка является свинец, ведущий техногенный загрязнитель среды. В здоровом организме цинк, в оптимальных концентрациях, обусловленных активностью цинксвязывающих лиганд в желудочно-кишечном тракте, ослабляет токсические эффекты данного ХЭ. Это объясняется способностью цинка индуцировать синтез металлотионеина, белка который связывает свинец и способствует его детоксикации. В то же время при цинкдефиците гонадо, гемо- и нефротоксичность свинца значительно возрастают [14].
Помимо названной, одной из известных пар ХЭ-антагонистов является свинец-селен. Интоксикация организма свинцом приводит к снижению усвоения селена, что отрицательно отражается на функции щитовидной железы, антиоксидантной системы, репродуктивной функции. В деятельности антиоксидантной системы селен участвует, входя в структуру молекулы некоторых ее ферментов [26]. Вследствие его блокирования возникают иммунодефицит, задержка процессов роста, кардиодистрофия, отставания в развитии репродуктивной системы, особенно юношей [24]. В России алиментарный дефицит этого ХЭ распространен главным образом в Забайкалье, где поступление его в организм не превышает половины от адекватного количества [14].
Учитывая значимость данных экологической физиологии для целей клинической диагностики, кроме определения ХЭ в биосубстратах, желательна регистрация специфических металлолигандов – биохимических показателей (гормоны, ферменты), которые отражают не только функциональную активность нейроэндокринных интеграций, но и , косвенно, уровень того или иного ХЭ в организме Сопоставление биохимических параметров с неорганическими, т.е. своеобразная «бионеорганическая» диагностика открывает возможность точнее определить, на донозологическом этапе, этиологические «мотивы» ФЗПР [9].
Дополнительным, уточняющим приемом этиологической диагностики может стать вычисление соотношений наноконцентраций в биосубстратах ХЭ-антагонистов, ослабляющих влияние друг друга на одни и те же физиологические процессы (например, половое созревание, гемопоэз и др.) Так, ранее нами была показана зависимость развития аномалий менструальной функции у девочек-подростков от степени отклонения от контрольных значений соотношений концентраций ряда ХЭ-антагонистов и предложен модифицированный прием этиологической диагностики дисфункции яичников (патент № 242869, 2011).
Дифференциация ФЗПР экологического генеза от аналогичной патологии обменной или генетической этиологии является недостаточно разработанным вопросом, он актуален, т.к. детерминирует специфику лечения, в определенной степени позволяет прогнозировать репродуктивную перспективность обследуемого.
Целью работы стала разработка патогенетических обоснований модификации способа этиологической диагностики ФЗПР у мальчиков-подростков с учетом данных бионеорганической диагностики, в сопоставлении их с антропометрическими и гормоно-биохимическими показателями.
Материалы и методы исследования
В работу были включены данные обследований 36 мальчиков-подростков 12-13 лет, при медосмотрах которых визуально были обнаружены признаки ФЗПР. Из обследований исключали подростков с явлениями крипторхизма, а также гипогонадизма, в этиологии которого могли участвовать генные мутации.
При сборе анамнеза было установлено, что все мальчики родились доношенными. Их родители не отличались поздним половым созреванием, следовательно, ФЗПР не имела наследственный характер. Обследуемые были разделены на 2 группы: 1-я – дети с ФЗПР на фоне первой степени экзогенно-конституционального ожирения, согласно классификации Ю.А. Князева (20 человек); 2-я – дети с ФЗПР при наличии признаков задержки пубертата соматогенного характера (16 человек).
Группу сравнения (10 человек) составили здоровые мальчики того же возраста.
Обследование включало в себя следующие исследования: анализ анамнестических данных и анитропометрические исследования с последующей оценкой физического развития;
– оценка развития мышечной системы: измерение силы кисти с помощью динамометра, становую силу определяли при помощи станового динамометра [5].
– оценка полового развития: на основании визуального осмотра и орхиметрии по шкале Таннера, по показаниям и с согласия родителей – УЗ исследование яичек;
– гормональные исследования: определение в сыворотке крови содержания гонадотропинов. тестостерона, лептина, кортизола методами иммуноферментного анализа (ИФА);
– энзимные исследования: определение в сыворотке крови активности щелочной фосфотазы методом ИФА как цинксодержащего фермента;
– аналитические исследования – рентгенофлуоресцентный анализ содержания ХЭ в волосах головы [14].
Статистическая обработка осуществлялась с использованием Excel-2007 и пакета прикладных программ STATISTICA – версия 0.0 (Stat-Soft, 2001).
Результаты исследования и их обсуждение
При осмотрах учащихся (1, 2 группы) было обращено внимание на недостаточно адекватное развитие вторичных половых признаков. Жалоб на это обстоятельство дети не предъявляли. Согласно анамнестическим данным матери во время беременности не переносили каких-либо серьезных заболеваний, поздних токсикозов. Гестации завершились физиологическими родами. В неонатальный период, по данным анамнеза, каких-либо обменных нарушений у детей отмечено не было.
Данные антропометрических исследований, значения росто-весового индекса представлены в табл. 1.
Таблица 1
Результаты антропометрических исследований подростков обследуемых групп
|
Группа обследуемых |
Масса тела, кг |
Рост, см |
Росто-весовой индекс, г/см |
Индекс относительной силы, % |
Становая сила, кг |
|
1 группа (20 человек) |
68,2 ±1,9 |
158,8±3,7 |
428,9±7,8 |
46,8 |
120,2±4,1 |
|
2 группа (16 человек) |
52,3 ±1,5* |
156,2±2,8 |
335,2±6,7* |
40,5 |
100,7 ±3,3* |
|
3 группа сравнения (10 человек) |
61,6±1,7 |
160,1±4,0 |
385,0±7,3 |
45,0 |
117,1±4,5 |
Примечание. * – отмечены значения, достоверно отличающиеся от данных группы сравнения
Как видно из данных табл. 1, низкие значения показателей росто-весового индекса и силовых характеристик мышечной системы были характерны для соматической задержки пубертата у детей 2 группы. Антропометрические параметры 1 группы демонстрировали наличие у подростков легкой степени ожирения, развитие мышечной системы не отличалось от таковой у детей группы сравнения .
При оценке вторичных половых признаков более низкие показатели имели место у мальчиков 2-ой группы. Большинство из них, по данным орхиметрии, отличались 1-ой стадией полового развития по шкале Таннера (табл. 2). В то же время, анализируя показатели можно было заключить, что половое становление детей 3 группы по шкале Таннера соответствовало 3-5 стадиям развития: у 40 % – 3 стадия, у 30 % – 4 и у 30 % – 5 стадия.
Таблица 2
Морфометрическая оценка полового развития детей , обследуемых групп
|
Группа обследуемых |
Длина пениса, см |
Ширина пениса, см |
Объем тестикул, мл |
Стадии полового развития (шкала Таннера), % случаев регистрации |
|
1 группа ( 20человек) |
4,58±0,35 |
1,32±0,1* |
3,7±0,3* |
1 стадия – 50 2 стадия – 30 3 стадия – 20 |
|
2 группа (16 человек) |
3,91±0,31* |
1,22±0,15* |
3,3±0,2* |
1 стадия – 75 2 стадия – 25 |
|
3 группа (10 человек) |
5,92±0,41 |
1,82±0,22 |
9,1±1,2 |
3 стадия – 40 4 стадия – 30 5 стадия – 30 |
Примечание. * – отмечены значения ,достоверно отличающиеся от данных 3 группы.
Сравнивая данные двух таблиц (1, 2), иллюстрирующих морфометрические показатели, можно отметить, что подростки группы сравнения отличались более гармоничным физическим развитием. У детей 2 группы были более выраженные признаки ретардации развития половых органов, по сравнению с 1-ой группой.
Для повышения информативности клинико-антропометрических наблюдений о функциональном состоянии детей, их адаптационных возможностей были проведены обзорные биохимические исследования. В результате было показано, что у детей 2 группы была снижена активность щелочной фосфотазы (ЩФ), что характерно для многих гипофункциональных состояний – гипотиреоз, токсикопатия. анемия и др. [10]. Активность ЩФ у детей 2 группы была 190,3 ± 4,8 МЕ/л. В то время как у детей 1-ой группы – 211,6 ± 5,1 МЕ/л, а группы сравнения (3-й) – 225,8 ± 5,4 МЕ/л.
При определении в крови общего холестерина, для верификации оценки выраженности нарушения жирового обмена, было обнаружено, что его значения в крови детей 1 группы достигали 5,2 ± 0,4 МЕ/л, что соответствовало показателям зоны риска для этого возраста. Возможно, это было связано с погрешностями в диете, богатой углеводами и жирами. У детей 3-ей группы показатель общего холестерина был 3,3 ± 0,1 ммоль/л, а у детей 2 группы – 2,8 ± 0,09 ммоль/л, что было даже ниже возрастных пределов колебаний данного биохимического показателя.
В лейкоцитарной формуле обращало на себя внимание более высокие значения показателей лимфоцитов у детей 1 группы. По сравнению с таковыми как у детей 2 группы, так и 3 группы (36,8 ± 2,1 %, 23,3 ± 1,3 и 30,6±2,1 %, соответственно). Признаков воспалительных процессов по клинико-биохимических данным ,у детей не было. Несколько повышенный уровень лимфоцитов у детей 1 группы возможно указывал на развитие реакции активации органов тимико-лимфатической системы при повышенном жировом обмене. Ее выраженность, как известно, координируется стресс-лимитирующими интеграциями.
Для более точной оценки полового развития, с учетом их морфо-функциональных параметров, были проведены соответствующие гормональные исследования.
Таблица 3
Содержание гормонов в крови мальчиков, обследуемых групп
|
Группы обследуемых |
ЛГ МЕ/л |
ФСГ МЕ/л |
Общий тестостерон нмоль/л |
Лептин нмоль/л |
Кортизол нмоль/л |
|
1 группа (20 человек) |
2,73±0,18 |
1,92±0,21* |
10,53±1,75* |
18,7±2,13* |
296,7±6,1 |
|
2 группа (16 человек) |
1,18±0,008* |
1,75±0,16* |
7,97±1,25* |
2,3±0,22* |
236,2±5,6* |
|
3 группа (10 человек) |
3,15±0,22 |
2,87±0,33 |
18,1±3,36 |
4,7±0,78 |
310,3±6,6 |
Примечание. * – отмечены значения, достоверно отличающиеся от данных 3 группы.
При анализе данных табл. 3 обращает на себя внимание, что более высокие показатели кортизола были у мальчиков 3 группы. Это свидетельствовало об их более высокой резистентности, по сравнению с детьми 1 и 2 группы. Очевидно, что гармоничное развитие организма сопровождалось более высоким уровнем его адаптационных возможностей. Уровень гонадотропинов (ЛГ, ФСГ) у мальчиков 1,2 групп был ниже, чем таковой у детей 3 группы. У мальчиков 2 группы был также значительно ниже показатель тестостерона относительно его параметров у детей 1 и 3 группы.
Резкие различия между показателями групп детей были обнаружены при регистрации концентраций лептина. Его контрольные значения особенно существенно отличались от таковых, характерных для детей с ожирением (1 группа). Как известно, этот гормон вырабатывается жировыми клетками (адипоцитами) и оказывает как тоническое, так и ингибирующее влияние на гипоталамический центр, поддерживающий постоянный уровень жира в организме, так называемый «адипостат» [22]. Основу этой интеграции составляют 2 группы нейронов. По данным Ф. Гриффина и др.(2008) [6] лептин ингибирует активность клеток гипоталамуса ( аркуатные ядра), которые высвобождают специфическое вещество – нейропептид У, стимулирующее аппетит, и , реципрокно, активирует нейроны, которые секретируют альфа-меланоцитостимулирующий гормон (МСГ). Первый из пептидов стимулирует потребление пищи и снижает энергозатраты, а второй (МСГ) – подавляет прием пищи и потенцирует энергозатраты. Автор , указанный выше, пришел к выводу, что лептин действует как сигнал отрицательной обратной связи, ограничивающий потребление энергии и отложение жира.
По сведениям Н.Б. Чагая и др.(2008) [19] избыточный уровень этого гормона в молодом возрасте, особенно в критические периоды онтогенеза, индуцирует снижение гонадотропной функции гипоталамуса-гипофиза, а, следовательно, задержку пубертата. Это явление нами было отмечено при обследовании 1 группы подростков. У детей 2 группы этот показатель, наоборот, был значительно ниже контрольных данных (группа 3).
Проведенные исследования доказывали, что этиология ФЗПР у обследуемых подростков имела различный характер. Для возможной роли геохимического фактора в возникновении данного патологического феномена у детей 2 группы были проведены анализы по определению ХЭ, играющих важную роль в становлении половой системы у мужчин ( цинк, селен) и их ведущего антагониста в аспекте биологических эффектов – свинца, который является наиболее распространенным экотоксикантом.
Определение концентрации ХЭ показало, что у подростков 3 группы показатели цинка и селена были выше, чем у детей 2 группы (табл. 4).
Таблица 4
Концентрация ХЭ в волосах детей, обследуемых групп
|
Группы обследуемых |
Цинк, мкг/г |
Селен, мкг/г |
Свинец, мкг/г |
Соотношение цинк/свинец, отн.ед. |
Соотношение селен/свинец, отн.ед. |
|
1 группа (20 человек) |
225,3±7,2 |
2,6±0,04 |
3,2±0,05 |
70,4±3,3 |
0,81±0,02 |
|
2 группа (16 человек) |
210,8±7,1* |
1,6±0,01* |
3,4±0,06 |
62,0±3,7* |
0,47±0,01* |
|
3 группа (10 человек) |
259,1±8,2 |
2,9±0,05 |
3,3±0,05 |
78,5±4,2 |
0,87±0,02 |
Примечание. * – отмечены значения, достоверно отличающиеся от данных 3 группы.
В то же время уровень свинца у всех групп был примерно одинаковым, что указывало на то, что техногенное загрязнение среды обитания детей было сходным. На фоне более высокого показателя концентрации цинка у детей 3 группы была выше активность элементспецифического фермента ЩФ.
Анализируя данные бионеорганических исследований можно было заключить, что между биохимическими и неорганическими показателями была прямо пропорциональная зависимость.
Как можно отметить из данных таблицы 4 более демонстративные отличия были обнаружены при рассмотрении величин показателей соотношения концентраций ХЭ-антагонистов, среди которых цинк и селен относились к категории эссенциальных ХЭ с низкой гомеостатической емкостью. Недостаток питания, приводящий к гипоэлементозу по эссенциальным ХЭ, может индуцировать активацию токсических влияний тяжелых металлов, которые при оптимальном рационе питания, компенсируются биологическими свойствами ХЭ-антагонистов и толерантностью элементного гомеостаза. Анализ показал, что уровень свинца в волосах не превышал известные ПДК для взрослых (для детей не разработаны), но относительно сниженное содержание селена, по сравнению с контрольными значениями, хотя и находились в пределах разброса нормы для взрослых, возможно выступило триггером обменных нарушений, способствующих задержке пубертата.
Селен входит в структуру молекулы ферментов антиоксидантной системы, во многом определяющей резервы резистентности организма. По данным таблицы 4 параметр соотношения селен/свинец у детей 2 группы был вдвое меньше, по сравнению с таковыми у подростков 1 и 3 групп. Это обстоятельство дает основание полагать, что регистрируемая концентрация селена и его физиологическая активность у детей 2 группы были недостаточными для адекватного развития вторичных половых признаков. В отношении цинка этот феномен был не столь выраженным. Однако можно заметить, что тенденция к снижению показателя соотношения концентраций указанной пары ХЭ также имела место. Это обстоятельство могло способствовать негативным сдвигам в развитии функциональных систем.
На наш взгляд, на примере данного случая, можно проследить за проявлением общего универсального принципа саморегуляции гомеостаза – принципа антагонистических отношений. Как известно антагонистический характер регуляции функций, основанный на балансировании взаимно противоположных влияний, в процессе эволюции оказался эффективнее всех других для поддержания равновесия во внутренней среде организма. Он влияет на слаженность в работе различных органов и систем, которую И.П. Павлов охарактеризовал как «художественная гармония» [13]. Возникновение ее «поломок» эндо- и экзогенного генеза манифестируется клинически определенным симптомокомплексом, в данном случае ФЗПР подростков.
Регистрируемая особенность соотношений концентраций ХЭ позволяет верифицировать экологический генез ФЗПР у мальчиков 2 группы, в отличие от такового у подростков 1 группы.
Можно заключить, что поскольку физиологическое влияние цинка и селена отличается репротропностью, то от их оптимального содержания в специфических тканях и соотношений с другими ХЭ зависит адекватность развития половых органов. Это предположение подкрепляют данные литературы. Так, известно, что селен необходим для биосинтеза тестостерона и нормального развития сперматозоидов [20]. Цинк, стимулируя белковой обмен, обеспечивает рост и развитие вторичных половых признаков, концентрируясь в органах половой системы. Самые высокие его концентрации, по данным Н.А. Агаджаняна и др. (2001) [2] обнаружены в простате. Он входит в состав семенной жидкости, обеспечивающий функциональную активность сперматозоидов, при его дефиците возникает мужское бесплодие [16, 21].
По данным Е.А. Даниловой и др. (2008) [6] информативность определения ХЭ меняется, в зависимости от стадии патологического процесса. Наиболее резкие изменения в концентрациях ХЭ и, соответственно, в их соотношениях имеют место на этапе острой стадии заболевания, т.е. в его начальный период.
Проведенные фундаментально-прикладные исследования междисциплинарного характера показали, что в условиях антропогенного загрязнения среды, эволюционно выработанные количественные соотношения между параметрами ХЭ, обеспечивающие оптимальные темпы роста и развития организма для конкретных климато-географических условий, нарушаются. Это детерминирует полиморфные девиации в регуляторных процессах, временно компенсируемые метаболическими реакциями. При их срыве транзиторный дисбаланс ХЭ-антагонистов может сменяться стабильным мономикроэлементозом, что манифестирует начало перехода из преморбидного состояния в болезнь, определенной специфики. Следовательно, микроэлементоз можно рассматривать в качестве триггера механизмов дизрегуляционной патологии, который может развиться еще на ранних этапах онтогенеза, сопровождаемый полиморфными физиологическими дисфункциями, в т.ч. и ФЗПР. В краткой форме этапы этого процесса представлены на схеме (рисунок).
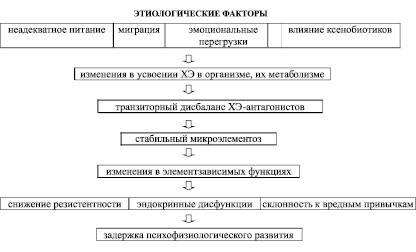
Патогенетическая схема ФЗПР подростков экологической этиологии
Актуальность исследований патофизиологии микроэлементозов, разработка их диагностических критериев имеет под собой общебиологическое обоснование. Так, известно, что в процессе эволюции живые организмы успешно приспосабливаются к специфике химического состава воды, с/х продуктов, воздуха того или иного региона. Согласно гипотезе Б.А. Шендерова (2001) [17] именно вода, минеральные вещества и симбиотические колонии микроорганизмов явились основой возникновения и эволюции растений и животных, включая человека. Эта историческая биологическая особенность стал условием онтогенеза, для которого необходимо оптимальное и стабильное содержание в среде и организмах упомянутых ингредиентов, являющихся пластичной константной организма. Автор гипотезы высказал предположение, что элементная система стала первичной основой всех современных механизмов регуляции у высших организмов (нервных, эндокринных, иммунных и др.), которые являются по отношению к ней, как бы надстройкой.
Очевидно, что в отличие от перечисленных, более «молодых» регуляторных интеграций, известный принцип Ле Шателье, согласно которому в высших биосистемах усиливаются ответные процессы, ослабляющие, в известных пределах, эффективность негативных экзовоздействий, для этого палеорегуляторного комплекса еще не свойственен.
Поэтому восстановление элементного гомеостаза, аномалии которого являются предикторами ФЗПР, возможно только искусственным путем, благодаря заместительной терапии соответствующими нутриентами.
Несомненно, что оптимальные соотношения ХЭ корригируют определенные «сбои» регуляции, вносят поправки в энтропийные и антиэнтропийные процессы и , тем самым, стабилизируют функции организма.
Таким образом, данные определений ХЭ в волосах и вычисление параметров соотношений пар специфических функциональных антагонистов, как объективный маркер микроэлементозной этиологии патологических изменений, актуальны для диагностических проблем детской эндокринологии и экологической патофизиологии человека. Выявленные особенности этиопатогенетических парадигм ФЗПР являются обоснованием к модификации алгоритма скринингового обследования детей для раннего выявления этиологических аспектов соматогенной задержки пубертата. В него необходимо включать определение концентрации ведущих эссенциальных и токсичных ХЭ в волосах, как в биосубстрате, отличающимся депонирующими свойствами, при этом необходимо иметь данные об их региональных нормативах. Это может способствовать повышению эффективности этиотропной терапии ФЗПР, исключить необходимость проведения сложных и дорогостоящих гормональных исследований.
Библиографическая ссылка
Кожин А.А., Попова В.А., Даурбекова М.А., Вербицкая О.Г., Новиковский Н.М. МИКРОЭЛЕМЕНТОЗЫ КАК ПРЕДИКТОРЫ ЗАДЕРЖКИ ПОЛОВОГО РАЗВИТИЯ МАЛЬЧИКОВ-ПОДРОСТКОВ // Международный журнал экспериментального образования. 2014. № 3-2. С. 49-55;URL: https://expeducation.ru/ru/article/view?id=4835 (дата обращения: 03.02.2026).

