Введение. Воспалительный процесс при панкреатите не ограничивается тканью железы, а носит системный характер с вовлечением в патологический процесс других жизненно важных органов (легкие, почки, печень) [1]. При экспериментальном остром деструктивном панкреатите (ЭОДП) во внутренних органах наблюдаются нарастающие процессы воспаления, альтерации и расстройства микроциркуляции [2,3,4,5]. У больных с хроническим и особенно острым панкреатитом наряду с абдоминальным синдромом возникают боли в сердце стенокардического характера, которые сопровождающиеся бледностью, потливостью, тахикардией, артериальной гипотонией и изменениями на электрокардиограмме. Кардиальный синдром при панкреатите исчезает параллельно с улучшением состояния больного [6]. Для выявления морфологических изменений, происходящих в организме свиней крупной белой породы при малоизученном и трудно диагностируемом поражении поджелудочной железы, нами был проведен эксперимент по моделированию острого панкреатита.
Материалы и методы исследования
Эксперимент проведен на кафедре хирургии и акушерства Вятской государственной сельскохозяйственной академии с соблюдением положений Европейской конвенции по защите домашних животных (№ 125 от 13.11.1987 г.). В опыт по моделированию острого деструктивного панкреатита включено 5 свиней крупной белой породы массой 5 – 5,5 кг, в возрасте 30 суток. Животных разделили на 2 группы: контрольную (1 животное) и экспериментальную (4 животных). Для премедикации использован препарат «Ветранквил» 1 % в дозе 1 мл / 100 кг массы. В качестве основного наркоза применялся препарат «Золетил 50» в дозе 15 мг / кг массы тела внутримышечно, местная инфильтрационная анестезия осуществлялась 0,5 %-ным раствором новокаина.
Показатели температуры тела, пульса, дыхания, характеризующие общий клинический статус, определяли до введения, затем через 10 минут после инъекции Золетила 50, а также через 1, 3, 7, 14 и 21 суток после воспроизведения острого панкреатита. Кровь для исследования морфологического состава брали из краевой вены уха в пробирки с гепарином (100 ЕД на 1 мл крови) до введения анестетиков, а также перед проведением эвтаназии на определенных ранее этапах эксперимента.
Для создания криогенной модели острого панкреатита по А.С.Канаяну (1985) в нашей модификации был предложен препарат «КриоФарма», который представляет аэрозоль, состоящий из смеси диметилэфира и пропана. Животные подвергнуты лапаротомии по белой линии живота и проведен срединный предпупочный разрез. Ткани брюшной стенки рассекали послойно по общепринятой методике. Двенадцатиперстную кишку вместе с поджелудочной железой находили в области правого подреберья, выводили из брюшной полости наружу в лапаратомную рану. Далее проводили аппликацию участка органа препаратом «КриоФарма» в течение 20 секунд. Затем выдерживали обработанный участок поджелудочной железы 1 минуту над операционным полем и вправляли обратно в брюшную полость. После этого на ткани белой линии живота накладывали непрерывный шов из кетгута, а на кожу прерывистые узловатые швы из шелка № 3. Контрольному животному была проведена лапаротомия без моделирования панкреатита.
При проведении исследования по моделированию острого деструктивного панкреатита (ОДП) использовался широкий спектр методов: клинические, гематологические, ультразвуковые и морфологические. При морфологическом исследовании поджелудочной железы оценивались её размеры, форма, контуры, консистенция, однородность паренхимы, наличие новообразований и определение их местонахождения.
При гистологическом исследовании миокарда оценивалось наличие неравномерной окраски миокарда (мелкие участки пересокращения кардиомиоцитов окрашены в более насыщенный цвет, соседние участки перерастяжения кардиомиоцитов более бледной окраски); состояние кровенаполнения миокарда: эритростазы, диапедезные микрогеморрагии; наличие нарушений реологии крови: лейкостазы, плазмостазы, сладжи; состояние межмышечной стромы; состояние стенок коронарных артерий; состояние кардиомиоцитов. При микроскопическом исследовании поджелудочной железы было установлено, что в ней развивался деструктивный панкреатит с образованием фокусов некроза и демаркационного воспаления.
В 1 сутки по моделированию панкреатита отмечено неравномерное кровенаполнение миокарда: участки слабого кровенаполнения чередуются с очагами венозно-капиллярного полнокровия (рис. 1). Наблюдается незначительный отек стромы сердца. Встречаются участки коронарных артерий со спазмом средних по диаметру сосудов.
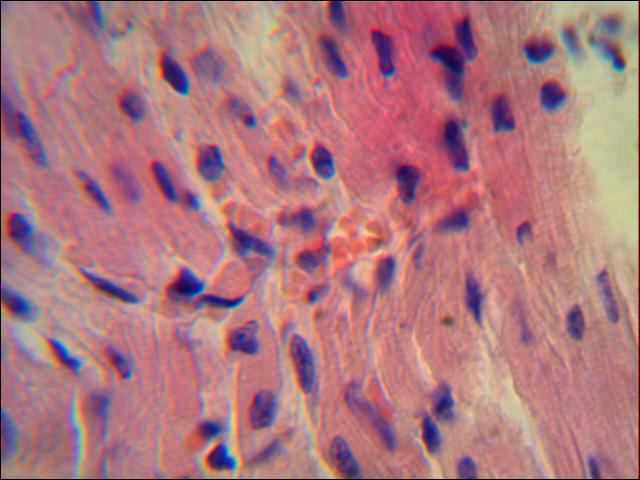
Рисунок 1. Участок миокарда свиньи с наполненными кровеносными сосудами в первые сутки ОДП. Незначительный отек стромы стенки сердца. Окраска гематоксилином и эозином. х 1000
На 3 сутки эксперимента нарастает неравномерное полнокровие миокарда. Отмечен периваскулярный склероз стенки артерий и липоматозный миокардит. Нарушение микроциркуляции выразилось в кровоизлияниях под эпикардом. Нарастает сосудистая реакция с диапедезными кровоизлияниями между кардиомиоцитами. В коронарных венулах встречаются сладжи эритроцитов.
Выраженный отек стромы с диапедезными кровоизлияниями между кардиомиоцитами наблюдается на 7 сутки ОДП. Структурные поражения паренхимы представлены пересокращениями миоцитов с явлениями митоза и потерей поперечно-полосатой исчерченности. В отдельных полях зрения отмечен выход в интерстиций мононуклеаров. Наблюдается фибринозное набухание сосудов миокарда с очагами спазмов некоторых сосудов. Отмечен васкулит средних коронарных артерий. Выраженная геморрагическая реакция подтверждает развитие очагового миокардита (рис.2).
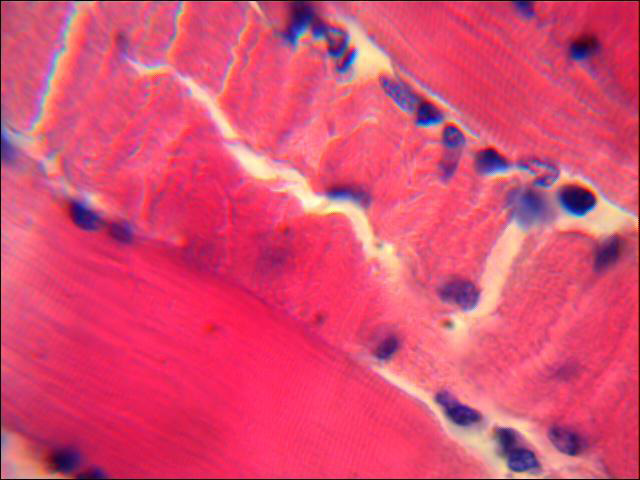
Рисунок 2 Участки волнообразной деформации миокардиоцитов с явлениями митоза в стенке сердца свиньи на 7 сутки при моделировании панкреатита. Окраска гематоксилином и эозином. х 1000
На 14 сутки по моделированию ОДП у свиней отмечен очаговый миоцитолиз кардиомиоцитов и отек стромы. Наблюдается неравномерное полнокровие сосудов миокарда. Местами миокард имеет волнообразный вид за счет пересокращений кардиомиоцитов. Отмечено пристеночное стояние лейкоцитов. Встречаются участки миокарда с незначительным выходом воспалительного инфильтрата в периваскулярное пространство.
К завершению эксперимента на 23 сутки в миокарде отмечены обширные кровоизлияния в интерстиции. Наблюдаются незначительные явления пересокращений кардиомиоцитов с отеком интерстициального пространства. Отмечен локальный периваскулярный склероз сосудов миокарда. В отдельных коронарных сосудах наблюдаются участки краевого стояния эритроцитов. Кардиомиоциты в состоянии белковой дистрофии (рис.3).
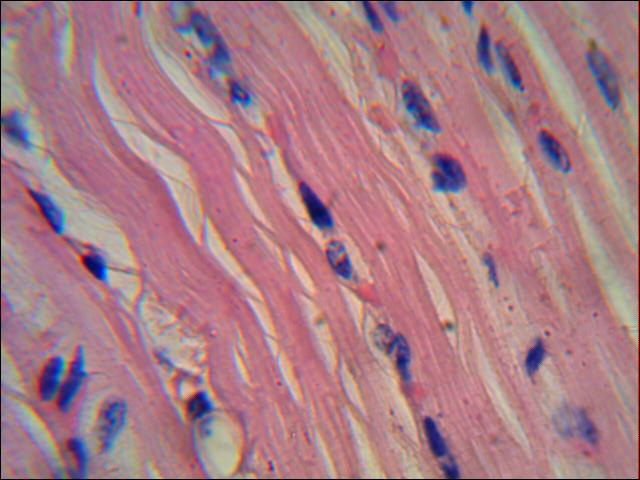
Рисунок 3 Незначительные явления пересокращений кардиомиоцитов с отеком интерстициального пространства. 23 сутки ОДП по моделированию панкреатита у свиньи. Окраска гематоксилином и эозином. х 1000
Обсуждение
Структурные изменения в миокарде (повреждение кардиомиоцитов в виде их пересокращений и значительным отеком интерстициальной ткани) могут быть связаны с циркуляцией медиаторов воспаления [1], а также действием на сердце специфического фактора депрессии миокарда, вырабатываемого поджелудочной железой при различных стрессовых состояниях [3]. Таким образом, причиной кардиодистрофии при остром деструктивном панкреатите является воспалительная реакция системного характера, ведущая в итоге к развитию множественной полиорганной дисфункции.
Библиографическая ссылка
Андреева С.Д. СТРУКТУРНЫЕ ИЗМЕНЕНИЯ МИОКАРДА ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ДЕСТРУКТИВНОМ ПАНКРЕАТИТЕ У СВИНЕЙ // Международный журнал экспериментального образования. 2014. № 5-1. С. 9-12;URL: https://expeducation.ru/ru/article/view?id=5616 (дата обращения: 13.01.2026).

