При определенных температурах и давлении из воды и природного газа образуются газовые гидраты, представляющие собой кристаллические вещества, описываемые формулой N·n·H2O, где N – молекула газа, n – число молекул воды в кристалле гидрата. К физически связанной воде обычно относят гигроскопическую воду, которая в виде молекул сконцентрирована на поверхности частиц породы и удерживается молекулярными силами. Как правило, чем меньше размер частиц породы, тем больше связанной воды находится в ней. С возрастанием глубины залегания появляется все больше веществ, в составе которых присутствует химически связанная вода. Динамика и состав таких кристаллогидратов, как правило, обусловлены геологическими и тектоническими особенностями горизонтов, компонентами которых они являются.
Наличие кристаллогидратной воды в составе различных газов может быть весьма значительным, поскольку с повышением давления возрастает и растворимость газов. Для таких глубоких газоносных горизонтов характерно содержание воды в сероводороде, метане и углекислом газе. Нередко, на значительных глубинах, отмечается содержание воды и в составе водорода, причем в значительных объемах.
Гидраты природных газов относят к клатратным соединениям, т.е. соединениям включения, поскольку внутрь полиэдрического каркаса могут проникать молекулы газа — «молекулы гости», которые связываются со структурой «хозяина» межмолекулярными взаимодействиями, в частности, образованием межмолекулярных водородных связей [1].
В таких кристаллогидратах, вследствие амбидентного характера молекул воды, проявляющегося в их способности выступать как электрон-донора, так и донора протона, в образование связей вовлекаются как атомы кислорода — координация к катионам, так и атомы водорода — образование межмолекулярных водородных связей.
Для указанного типа взаимодействий характерно формирование межмолекулярных контактов типа O - Н ... R (R = азот, фтор, кислород) и участие в формировании координационных полиэдров других атомов. Молекулы воды в таких структурах стремятся давать локальные фрагменты с атомами или ионами основного соединения, в состав которого они включаются.
Прецизионными рентгеноструктурными исследованиями, позволяющими локализовать положение атомов водорода с высокой степенью точности, установлено, что при небольших отрицательных и невысоких положительных температурах, молекулы воды, содержащиеся в органических клатратных соединениях, могут образовывать полиэдрические структуры, характеризующиеся наличием межмолекулярных Н-связей.
Следует отметить, что энергия межмолекулярной водородной связи (20-40 кДж/моль), по крайней мере, на порядок меньше энергии ковалентных взаимодействий. Соответственно, невелики и те изменения в распределении электронной плотности, которые возникают вследствие образования водородной связи. Тем не менее, прецизионные рентгеноструктурные исследования позволяют такие изменения фиксировать и получать ценную информацию о природе и проявлениях Н-связей [2].
Взаимодействие атомов, участвующих в Н-связи и составляющих так называемый Н-комплекс, в принципе включает в себя следующие эффекты: электростатическое взаимодействие, поляризацию, перенос заряда, обменное и дисперсионное взаимодействия.
Электростатическое взаимодействие представляет собой кулоновское взаимодействие зарядов, без какого бы то ни было их перераспределения. Поляризация и перенос заряда — эффекты, обусловленные перераспределением электронной плотности внутри взаимодействующих молекул и между ними, соответственно. Обменное взаимодействие представляет собой, в данном случае, отталкивание и отражает ограничения, налагаемые на электронное строение молекул принципом Паули. Дисперсионный вклад возникает как следствие корреляции электронов во взаимодействующих молекулах.
На рис. 1 показано распределение электронной плотности формальдегид – вода. В данном случае, именно поляризация стабилизирует H – связь данного типа. Таким образом, эффект образования Н-связи, по существу, сводится к увеличению полярности функциональных групп, присутствующих в изолированных молекулах.
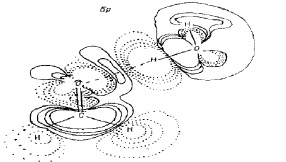
Рис.1 Суммарное распределение деформационной электронной плотности
для системы формальдегид – вода
Рентгеноструктурными исследованиями установлено, что при небольших отрицательных и при невысоких положительных температурах молекулы воды могут образовывать полиэдрические структуры. В таких структурах имеются полости, размеры которых значительно больше расстояний между молекулами воды в обычной гексоганальной структуре льда. Внутрь полиэдрического каркаса могут проникать молекулы газов, которые связаны с каркасом «хозяина» Ван-дер-Ваальсовскими силами.
На рис.2 приведены энергетически наиболее выгодные, т.е. устойчивые кристаллические структуры гидратов. В вершинах этих многогранников находятся атомы кислорода, а ребрам соответствуют водородные связи. Полости таких структур могут занимать как небольшие по размерам молекулы — СН4, Ar, H2S, так и крупные — С2Н6, С4Н|6.
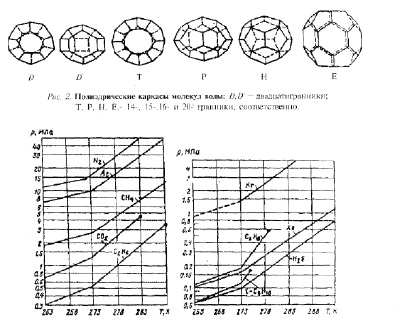
Рис. 3 Условия образования гидратов некоторых газов
На рис.3 приведены графики устойчивого образования гидратов некоторых газов.
Исследование структуры гидратированных соединений может внести большую ясность о поведении ионов или молекул изучаемых веществ, поскольку их физические свойства могут быть правильно интерпретированы только в зависимости от их строения, в особенности, от расположения молекул воды и способа их связи с молекулами изучаемых соединений. Особенности структуры веществ проявляются на их механических, электрических и термических свойствах, что является прямым следствием расположения молекул воды и способа их связи с фрагментами структуры.
Библиографическая ссылка
Макитова Д.Д., Нагаев В.Б., Шомахов И.В. ГАЗОВЫЕ ГИДРАТЫ И ИХ СВОЙСТВА // Международный журнал экспериментального образования. 2014. № 8-1. С. 86-88;URL: https://expeducation.ru/ru/article/view?id=5807 (дата обращения: 08.03.2026).

