Хроническая воспалительная демиелинизирующая полиневропатия (ХВДП) – дизиммуное заболевание, приводящее к поражению периферической нервной системы, относящееся к классу миелинопатий. Вероятность прогрессирования заболевания при отсутствии своевременной диагностики и патогенетического лечения высока. Сенсорный вариант ХВДП часто недооценивается из-за отсутствия четких диагностических критериев и атипичного течения. Однако ранняя диагностика играет важную роль в предотвращении последующей за демиелинизацией неизбежной аксональной дегенерации, которая ведет к развитию стойкого неврологического дефицита. Сенсорные варианты ХВДП входят в группу распространенных на уровне первичного звена здравоохранения крипттогенных периферических полиневропатий. Авторы приводят классические и новые алгоритмы диагностики сенсорной ХВДП, которые доступны для использования на амбулаторно-поликлиническом этапе врачами общей практики, неврологами, врачами функциональной диагностики.
Пациенты с заболеваниями периферической нервной системы (ПНС) составляют значительную часть больных стационаров и поликлиник, внося существенный вклад и в структуру общей заболеваемости населения. Среди таких заболеваний 67 % составляют полиневропатии (ПНП). Однако, по некоторым данным, основанным на результатах выборочных осмотров больших групп населения, число больных с невропатией составляет до 20 % от числа обследованных [3–5], что, вероятнее всего, обусловлено существующими проблемами ранней инструментальной (нейрофизиологической) диагностики периферических ПНП на уровне амбулаторно-поликлинического звена здравоохранения, в том числе и врачами общей практики [5, 13]. В структуре причин временной нетрудоспособности заболевания ПНС в России составляют 7–10 % (по числу, как больных, так и дней нетрудоспособности) [5]. Даже при самом тщательном обследовании в специализированных клиниках причина ПНП остается неизвестной примерно в 25 % случаев, а в неспециализированных клиниках нозологического диагноза не имеют 50 % больных [5, 27, 35]. Поздняя диагностика сенсорных форм хронических ПНП (в том числе, диабетической, наследственной, демиелинизирующей, паранеопластической, алкогольной), не позволяет провести своевременное лечение, что приводит к снижению или утрате трудоспособности и ухудшению качества жизни пациентов. Около 20–50 % из недиагностированных полиневропатий составляют сенсорные варианты хронической воспалительной демиелинизирующей полиневропатии (ХВДП) [27], особенно в регионах с тяжелыми климато-географическими условиями.
Несмотря на то, что в последние годы достижения экспериментальных и клинических нейронаук позволили далеко продвинуться в понимании механизмов развития многих периферических ПНП и, что особенно важно, существенно расширить возможности их диагностики и лечения [11, 13, 14], выявление этого заболевания врачами первичного звена здравоохранения, зачастую, осуществляется на поздних стадиях патологического процесса, когда эффективность лечения уже низкая. Проблема ранней диагностики и целенаправленного лечения ХВДП имеет большое практическое значение, прежде всего потому, что данное заболевание относится к категории курабельных, а течение и исход его во многом определяются сроками начала лечения. Поздняя диагностика чревата упущенными терапевтическими возможностями. Для диагностики сенсорного варианта ХВДП важным является междисциплинарный подход и тесное взаимодействие невролога с врачами других специальностей – терапевтами, врачами общей практики, эндокринологами, онкологами, наркологами, урологами, ревматологами и др. [5], поскольку пациенты с рассматриваемой патологией на доклиническом этапе попадают именно к этим специалистам, а к врачам-неврологам – на развернутой стадии заболевания или с признаками инвалидизирующего состояния. Группу риска сенсорного варианта ХВДП составляют также пациенты с сахарным диабетом и с хроническими нейроинфекциями (в первую очередь, герпетическими – до 45 %), в связи с вторичными иммунодефицитными состояниями [2, 19, 48].
Дефиниция
Термином «полиневропатия» (ПНП) обозначают множественное поражение периферических нервов. Если в патологический процесс вовлекаются спинномозговые корешки, то говорят о полирадикулоневропатии. Проявления ПНП широко варьируют, различаясь скоростью прогрессирования, выраженностью симптомов, соотношением чувствительных и двигательных расстройств, а также наличием симптомов раздражения [2, 5, 8, 20]. ПНП делят на две основных группы: в одних случаях преимущественно поражаются отростки (аксоны) нервных волокон (аксональные, или аксонопатии), в других – миелиновые оболочки (демиелинизирующие невропатии или миелинопатии). Их дифференциация имеет важное диагностическое и прогностическое значение.
ХВДП – дизиммунное заболевание, характеризующееся поражением миелиновой оболочки периферических нервов [16–18]. В целом, в амбулаторно-поликлинической практике около 20–50 % криптогенных полиневропатий составляет ХВДП [5–7, 19, 20]. Классификация ХВДП постоянно усложняется: выделяют новые формы, яснее становятся причины многих клинических проявлений [6, 8, 27]. В патогенезе различных клинических форм ХВДП на первый план выходит процесс демиелинизации, считающийся одним из универсальных процессов повреждения различных структур нервной системы. Однако, по мере прогрессирования ХВДП к процессам демиелинизации неизбежно присоединяются процессы аксонального перерождения.
Частота встречаемости ХВДП в Великобритании, Австралии, Италии, Японии и США составляет 0,8–9,0 на 100 тыс. населения [28, 34, 42, 43]. Распространенность тяжелых (преимущественно моторных) форм ХВДП в европейской части России составляет 1–3 на 100 тыс. населения [15]. В Красноярском крае распространенность сенсорных и моторных форм ХВДП достигает 25,5 на 100 000 взрослого населения [19], что выше, чем в доступных литературных данных и может быть объяснено высокой частотой вторичных иммунодефицитных состояний, хронических нейровирусных инфекций среди населения, проживающего в условиях Сибири [19, 28, 34, 38]. Ежегодно в России регистрируется 0,15 случая ХВДП на 100 тыс. населения [15]. Пик заболеваемости ХВДП приходится на возраст 50–60 лет [34]. ХВДП среди лиц пожилого возраста является второй по частоте ПНП, вызывающей инвалидизацию.
ХВДП является приобретенной ПНП, в развитии которой большое значение играют изменения иммунологической реактивности организма с возникновением аутоиммунного процесса [1, 25, 29, 32, 33, 48], что нередко приводит к выраженным двигательным и чувствительным нарушениям и имеет серьезный прогноз [37]. ХВДП часто недооценивается врачами первичного звена здравоохранения в связи с ее гетерогенными проявлениями (как клиническими, так и электрофизиологическими), ограничениями диагностических критериев, а также из-за недостатка знаний среди данной категории врачей [1, 4, 11, 13]. Ранняя диагностика и своевременно назначенное лечение позволяют сохранять трудоспособность и отсрочить развитие признаков инвалидизации.
Сенсорный вариант ХВДП следует подозревать у всех пациентов с симметричной или асимметричной полиневропатией, которая имеет прогрессирующее или ремитирующее клиническое течение более 8 недель, особенно, если клинические признаки включают позитивные сенсорные симптомы, арефлексию без парезов, или избирательное снижение вибрационной чувствительности и глубокого проприоцептивного чувства с проявлениями сенситивной атаксии [6, 5, 7, 8, 23, 47].
Патогенез
Патогенез ХВДП остается до конца не выясненным, но связан с иммунодефицитным состоянием с вовлечением Т-клеточного звена иммунитета, с нарушением гемато-неврального барьера, экспрессией фактора некроза опухоли (ФНО), интерлейкинов, цитокинов, интерферонов, а также с участием гуморального звена иммунитета, что подтверждено эффективностью внутривенного введения иммуноглобулина класса G в опытах на крысах [29, 39, 41, 46, 45, 48]. При ХВДП в сыворотке крови больных выявляются разные классы аутоантител к ганглиозидам GM1 (IgG – в 23 %, IgA – в 14 % и IgM – в 7 % случаев). Существенную роль в развитии демиелинизации при ХВДП играют макрофаги, отслаивающие миелин, что приводит к его дегенерации. Также в очагах воспаления обнаруживают СD4+- и СD8+ лимфоциты [5, 11, 12, 32, 33, 46].
До сих пор специфические антигены, провоцирующие процесс демиелинизации, не идентифицированы. По данным Е.А. Кантимировой [19], в развитие ХВДП огромный вклад вносят нейротропные вирусы семейства Herpes viridae, так у 45 % пациентов с ХВДП была верифицирована хроническая вирусная инфекция, вызванная вирусом простого герпеса 1 типа (ВПГ-1), в 4,5 % случаев – цитомегаловирусная инфекция (ЦМВ) и инфекция, вызванная вирусом Эпштейн-Барра (ВЭБ), в 22,6 % случаях выявлена микст-инфекция (сочетание ВПГ-1 и ВЭБ, ЦМВ и ВЭБ).
Классификация
Клиническая классификация по течению ХВДП: быстро прогрессирующее (нарастание симптомов от 3 до 6 месяцев); умеренное прогрессирующее (непрерывное или пошаговое нарастание симптомов); медленно прогрессирующее (постепенное нарастание симптомов в течение 1 года); рецидивирующее (частичное или полное восстановление функций между периодами обострений). Ремиссия определяется как отсутствие симптомов ХВДП без лечения как минимум в течение 1 года.
По распределению симптомов выделяют следующие формы: асимметричную, дистальную, парапаретическую (с преимущественным вовлечением нижних конечностей).
Клиника
Клинические формы ХВДП включают синдром Левиса-Самнера (приобретенную мультифокальную демиелинизирующую сенсорно-моторную невропатию), преимущественно сенсорную ХВДП, приобретенную дистальную демиелинизирующую сенсорную невропатию, ХВДП с поражением центральной нервной системы (ЦНС) [29, 36–38, 44].
Классическая картина ХВДП проявляется моторными нарушениями, преобладающими над сенсорными, со слабостью в проксимальной или дистальной мускулатуре преимущественно нижних конечностей, арефлексией или гипорефлексией глубоких рефлексов. Моторный вариант ХВДП имеет более тяжелое течение [23, 37, 38, 45]. Поражение краниальных (черепных) нервов и бульбарные нарушения развиваются в 10–20 % случаев [24].
При сенсорных вариантах ХВДП в патологический процесс вовлекаются толстые миелинизированные волокна Аβ типа периферических нервов конечностей, что проявляется нарушением вибрационной чувствительности, а также тонкие слабо миелинизированные волокна, ответственные за температурную чувствительность [2, 47]. Чувствительные нарушения чаще начинаются с нижних конечностей. Нарушения вибрационной чувствительности преобладают над температурными и болевыми расстройствами. Для отдельных пациентов характерна болевая дизестезия. Иногда может возникать дорсалгия, что связано с вовлечением спинномозговых корешков. Сенситивная атаксия различной степени выраженности обусловлена поражением задних корешков и связана с нарушением проприоцептивной чувствительности [45, 47]. Редко выявляется картина спинального стеноза и синдрома конского хвоста [42]. При ХВДП, ассоциированной с моноклональной гаммапатией неопределенного значения (IgA/IgG парапротеинемических полиневропатиях), сенсорные симптомы могут сопровождаться умеренной слабостью мышц в дистальных отделах конечностей, отмечается медленно прогрессирующее течение [12, 38]. Вегетативные нарушения могут проявляться расстройствами потоотделения чаще по типу гипергидроза (локального повышенного потоотделения на уровне кистей и стоп), акроцианозом (снижением локальной температуры дистальных отделов нижних и верхних конечностей) с повышенной зябкостью кистей и стоп, иногда с развитием вторичного ангиотрофоневротического синдрома с холодовой и тепловой дизестезией, нарушением трофики кожи и ее производных (ногтей, волос). Нарушения тазовых функций по типу запора и задержки мочи встречаются в тяжелых случаях ХВДП [30, 38].
Диагностика
В настоящее время в диагностике ХВДП используются такие методы как электромиография (ЭМГ), биопсия нерва и исследование спиномозговой жидкости (СМЖ, ликвора) [22, 38, 42, 49]. В частности, к электрофизиологическим критериям диагностики ХВДП относятся: частичный блок проведения, замедление скорости проведения импульса (СПИ), длительные дистальные моторные задержки, задержка или исчезновение F-волн, дисперсия и расстояние обусловливают снижение амплитуды потенциала действия моторного ответа (М-ответа). К сожалению, эти критерии ЭМГ характерны для демиелинизирующего процесса в целом и не являются строго специфичными для сенсорной ХВДП [19, 22, 23, 26, 31, 32, 39, 40]. Более того, электрофизиологические изменения могут напоминать таковые при хронической воспалительной аксональной полиневропатии [14, 21, 36].
При биопсии нерва выявляются признаки демиелинизации и ремиелинизации, а также образование локальных «луковиц» (увеличение нерва в поперечном сечении за счет повторных оборотов и процессов пролиферации в шванновских клетках, окружающих аксоны, в результате повторных эпизодов демиелинизации и ремиелинизации) [32, 49]. К дополнительным признакам относятся интерстициальный отек и эндоневральная воспалительная клеточная инфильтрация макрофагами и лимфоцитами [38, 49]. В связи с инвазивностью этого метода диагностики его применение в случаях сенсорных вариантов ХВДП на амбулаторно-поликлиническом этапе здравоохранения не оправдано с экономической и клинической точек зрения.
При исследовании ликвора выявляется белково-клеточная диссоциация, при этом уровень белка может быть повышен в десятки раз [23], однако этот диагностический критерий наиболее типичен для классического моторного варианта ХВДП и приемлем к использованию лишь в условиях круглосуточного стационара.
Одним из современных методов диагностики ХВДП является анализ сыворотки крови и ликвора в сочетании с комплексной оценкой иммунологических показателей (в том числе определение антител к ганглиозидам, частота выявляемости которых составляет 40 %) [10, 14, 21]. C поражением чувствительных нервов ассоциировано наличие антител в сыворотке пациентов к ганглиозидам GD1b, GD2, GD3, GT1b, GQ1b.
Однако инвазивные методы (биопсия нерва и люмбальная пункция) не применимы в амбулаторной практике и не целесообразны для популяционного скрининга. В настоящее время не разработаны единые ЭНМГ-критерии диагностики сенсорного варианта ХВДП в виду высокой вариабельности сенсорных ответов с дистальных отделов периферических нервов у человека [32, 40]. Это требует разработки и внедрения новых алгоритмов нейрофизиологической диагностики сенсорного варианта ХВДП.
Новый алгоритм диагностики сенсорного варианта ХВДП
Особый интерес в клиническом плане для врачей первичного звена здравоохранения представляет сенсорный вариант ХВДП, который составляет до 50 % криптогенных форм ПНП [27]. Чаще всего пациенты с сенсорным вариантом ХВДП пропускаются на уровне амбулаторно-поликлинического звена здравоохранения, поскольку на начальных стадиях заболевания субъективных жалоб пациенты, как правило, активно не предъявляют. При углубленном опросе возможно выявить жалобы на нечеткие парестезии в дистальных отделах конечностей, потливость, зябкость стоп, боли в икроножных мышцах и голеностопных суставах. Для диагностики сенсорного варианта ХВДП важно проведение полимодального исследования чувствительности: определение болевой чувствительности с помощью многоигольчатого неврологического валика (рис. 1), температурной – с помощью тип-терма (рис. 2), тактильной чувствительности – с использованием монофиламента (рис. 3), вибрационной ̶ с помощью неградуированного или градуированного камертона (С 126 Гц) (рис. 4). Это важно с клинической точки зрения, потому что выявление мультимодальных нарушений склоняет в пользу полиневропатии, то есть дифференцирует эти неспецифические жалобы с радикулопатиями. Снижение вибрационной и проприоцептивной видов чувствительности свидетельствует в пользу повреждения преимущественно толстых миелинизированных волокон, то есть указывает на то, что имеет место такой патологический процесс, как демиелинизация. Напротив, болевая и температурная гипостезия указывает на повреждение немиелинизированных и слабомиелинизированных нервных волокон.
При неврологическом осмотре важно не пропустить нарушение болевой чувствительности по полиневритическому типу. Для сенсорного варианта ХВДП характерен симптом «перчаток» и «носков» в виде, чаще, гиперстезии (повышения болевой чувствительности) или, реже, гипостезии (снижения болевой чувствительности) на уровне нижних и верхних конечностей. Степень тяжести полиневритических расстройств болевой чувствительности нарастает в направлении от проксимальных отделов конечностей к дистальным, от нижних конечностей к верхним [2]. При сборе анамнеза особое значение следует уделять наличию различных проявлений герпетической инфекции (кожный, лабиальный, генитальный и т.д.) и семейным случаям герпесвирусной инфекции. Отсутствие указаний на герпетические проявления в прошлом не исключает ХВДП, необходимо назначение иммуноферментного анализа (ИФА) крови на антитела IgM и IgG к вирусам семейства Herpes viridae с авидностью, а также исследование иммунного статуса. Очевидно, что выявление анамнестических данных о длительном злоупотреблении алкоголя заставит в первую очередь исключать алкогольную полиневропатию, обусловленную хронической интоксикацией этанолом и дефицит нутриентов. Также важно помнить, что наличие у пациента сахарного диабета полностью не является исключающим для ХВДП признаком, поскольку известны формы ХВДП, ассоциированные с сахарным диабетом. Однако в последнем случае речь не идёт об изолированно сенсорных вариантах полиневропатий.
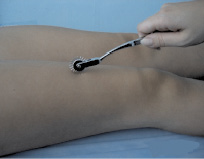
Рис. 1. Исследование болевой чувствительности на нижних конечностях при помощи неврологического валика: болевое раздражение наносится путем медленного прокатывания игольчатого неврологического валика в направлении от проксимальных отделов к дистальным, последовательно с двух сторон при отключении контроля зрения (при закрытых глазах пациента) [2]

Рис. 2. Исследование температурной чувствительности при помощи тип-терма [2]

Рис. 3. Методика исследования тактильной чувствительности на стопах помощью монофиламента 5.07 Semmes-Weinstein весом 10 грамм [2]
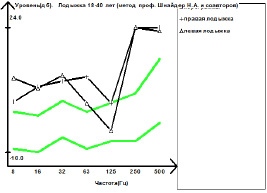
Вибрационная чувствительность может снижаться задолго до возникновения других признаков сенсорного варианта ХВДП, для ее диагностики перспективна методика компьютерной паллестезиометрии. В 2009–2011 гг. Шнайдер Н.А. и соавт. было показано, что нарушение вибрационной чувствительности выявляется при проведении компьютерной паллестезиометрии у пациентов с различными формами ПНП на высоких и низких частотах на начальной стадии патологического процесса, когда пациент уже предъявляет жалобы, а камертональная проба еще отрицательная [2, 18]. Отечественный компьютерный аппарат «Вибротестер-MBN» ВТ-02-1 (Москва, РФ) был адаптирован группой красноярских ученых для диагностики диабетической ПНП и наследственной невропатии Шарко-Мари-Тута [2, 18], в то время как при сенсорном варианте ХВДП эта методика стала использоваться нами с 2013 г. Исследование вибрационной чувствительности при сенсорном варианте ХВДП рекомендуется проводить в широком спектре диапазона частот (8, 16, 32, 64, 128, 250 и 500 Гц), что позволяет дифференцировать степень тяжести поражения толстых миелинизированных волокон Аβ типа периферических нервов верхних и нижних конечностей (рис. 5, 6).
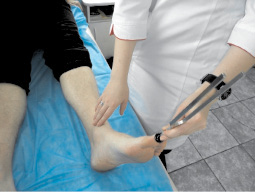
Рис. 4. Исследование вибрационной чувствительности при помощи камертона С128 в области концевой фаланги большого пальца стопы [2]
 а
а 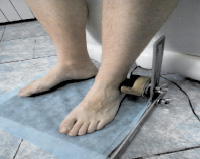 б
б
Рис. 5. Исследование вибрационной чувствительности с дистальных отделов верхних и нижних конечностей с помощью «Вибротестера-MBN» ВТ-02-1 (Москва, РФ): а – с шиловидного отростка локтевой кости; б – с наружной лодыжки в положении пациента сидя [2]
Для оценки состояния температурной чувствительности с возможностью определения тепловой, холодовой чувствительности и болевых порогов на воздействие тепла и холода фирмой MБН (Москва, РФ) в 2012 г. разработано новое отечественное компьютерное диагностическое оборудование «Термосенсотестер», проходящее в настоящее время этап апробации у пациентов с сенсорным вариантом ХВДП на базе кафедры медицинской генетики и клинической нейрофизиологии КрасГМУ им. проф. В.Ф. Войно-Ясенецкого [2]. Данное диагностическое оборудование ранее, как в норме, так и при различных ПНП не использовалось, что побудило нас провести исследование порогов болевой (тепловой и холодовой) чувствительности и референсных коридоров температурной (тепловой и холодовой) в норме и при патологии. Метод зарекомендовал себя как чувствительный при поражении тонких немиелинизированных и слабомиелинизированных (С и А-дельта) сенсорных нервных волокон, что позволило включить его в диагностический алгоритм сенсорного варианта ХВДП (рис. 7).
 а
а
 б
б
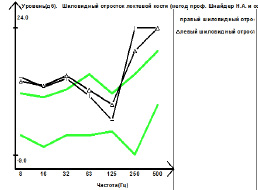
Рис. 6. Виброграмма пациента И., 25 лет, с сенсорным вариантом ХВДП (исследование проводилось на аппарате «Вибротестер-MBN» ВТ-02-1 (Москва, РФ): а – с шиловидного отростка локтевой кости; б – с наружных лодыжек. По данным компьютерной паллестезиометрии с дистальных отделов верхних конечностей (шиловидный отросток) выявлено двустороннее снижение вибрационной чувствительности в широком спектре диапазона частот, с тенденцией к выпадению на высоких частотах (250, 500 Гц). По данным компьютерной паллестезиометрии с дистальных отделов нижних конечностей (лодыжки) выявлено снижение вибрационной чувствительности в широком диапазоне частот с обеих сторон, с тенденцией к выпадению на высоких частотах (250, 500 Гц). В клиническом аспекте выявленные изменения характерны для демиелинизирующего поражения толстых миелиновых волокон Аβ типа дистальных отделов периферических нервов верхних и нижних конечностей легкой степени
С целью определения степени нарушения стабильности основной стойки, обусловленной вовлечением волокон глубокой чувствительности и других структур, участвующих в поддержании равновесия, в настоящее время широко применяется метод стабилометрии как интегральный способ оценки психофизиологического состояния человека, основанный на регистрации и анализе траектории центра давления, формируемого вертикально стоящим человеком на плоскость опоры за определенный период времени [9, 17]. При диагностике сенсорного варианта ХВДП нами проводится обследование на диагностико-реабилитационном комплексе MБН (Москва, РФ) в покое с использованием установки стоп в европейской стойке с открытыми и закрытыми глазами пациента (отключением контроля зрения) для дифференцировки типа атаксии (рис. 8). При сенсорном варианте ХВДП регистрируются признаки сенситивной атаксии, выраженность нарушений равновесия нарастанием при отключении контроля зрения.

Рис. 7. Методика проведения исследования температурной чувствительности на отечественном компьютерном диагностическом оборудовании «Термосенсотестер» (MБН, Москва, РФ) [12]

Рис. 8. Стабилометрия у пациента с сенсорным вариантом ХВДП на диагностико-реабилитационном комплексе MBN (г. Москва) [фото Поповой Т.Е., 2014]: проба Ромберга по европейскому варианту установки стоп, пациент фиксирует взор в точке на экране монитора, проба проводится с открытыми и закрытыми глазами для уточнения наличия и степени тяжести сенситивной атаксии
Для оценки степени вовлечения в патологический процесс вегетативных волокон периферических нервов, включая nervi vasorum, и выраженность вторичного ангиотрофоневротического синдрома на уровне дистальных отделов нижних конечностей у пациентов с сенсорным вариантом ХВДП в диагностическом алгоритме нами также используется метод транскутанной оксиметрии на аппарате «Radiometer TC 4 series» (Копенгаген, Дания), позволяющий определить состояние микроциркуляции у пациентов с акроцианозом голеней и стоп по уровню трансдермального содержания кислорода (рис. 9, 10). Ранее данная методика использовалась для оценки риска развития синдрома диабетической стопы у пациентов с диабетической полиневропатией [2, 16].
Кроме вышеуказанных новых нейрофизиологических методик, которые ранее не применялись в диагностике сенсорного варианта ХВДП, в разработанный нами диагностический алгоритм традиционно входит стимуляционная ЭНМГ, включая определение СПИ по моторным и сенсорным волокнам, F-волны, М-ответа. Однако, как уже говорилось выше, для этого атипичного варианта ХВДП может быть характерно отсутствие типичных признаков демиелинизации. В качестве уточняющих методов могут быть использованы: анализ S-ответов лучевого и икроножного нервов, исследование сомато-сенсорных вызванных потенциалов. В наиболее сложных диагностических случаях приходится прибегать к исследованию СМЖ (при ХВДП повышается концентрация белка в ликворе), в крайне редких случаях – проводится биопсия чувствительного (икроножного или поверхностной ветви лучевого) нерва.
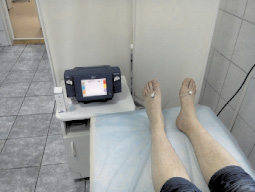
Рис. 9. Транскутанная оксиметрия у пациента с сенсорным вариантом ХВДП на аппарате «Radiometer TC 4 series» (Копенгаген, Дания) [фото Поповой Т.Е., 2014]: уровень трансдермального содержания кислорода определяется в дистальных отделах нижних конечностей (тыл стоп и голень) и позволяет уточнить наличие и степень тяжести нарушений функции вегетативных волокон периферических нервов и вторичного ангиотрофоневритического синдрома
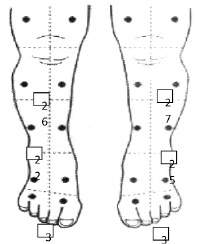
Рис. 10. Результаты транскутанной оксиметрии у пациента Ф., 28 лет, с сенсорным вариантом ХВДП средней степени тяжести с ангиотрофоневритическим синдромом на аппарате «Radiometer TC 4 series» (Копенгаген, Дания) (в мм рт.ст.): зарегистрировано снижение уровня транскутанного напряжения кислорода с обеих сторон на стопах легкой/умеренной степени, на уровне голеней – умеренной/выраженной степени тяжести
В целом, учитывая преимущественное поражение сенсорных волокон периферических нервов при сенсорном варианте ХВДП и доступность рассматриваемого диагностического оборудования, предложенный и внедренный нами в клиническую практику новый алгоритм представляется перспективным для нейрофизиологической диагностики рассматриваемой патологии периферической нервной системы (рис. 11).
Специфичность предложенного алгоритма при рассматриваемом варианте ХВДП объясняется возможностью объективно оценить степень нарушения чувствительных (болевых, тактильных, вибрационных, температурных, проприоцептивных) и вегетативных волокон периферических нервов, что было затруднено при ранее предложенном классическом алгоритме диагностики ХВДП в целом. Кроме того, наш многолетний опыт работы показывает, что применение нового алгоритма позволяет не только верифицировать сенсорный вариант ХВДП, проводить дифференциальную диагностику с другими клиническими формами, но и оценивать эффективность медикаментозной и немедикаментозной терапии в динамике.
Заключение
Таким образом, сенсорный вариант ХВДП представляет особую актуальность для специалистов амбулаторно-поликлинического звена здравоохранения (врачей общей практики, терапевтов, неврологов, врачей функциональной диагностики). Важность диагностической настороженности в отношении своевременного выявления этого заболевания объясняется высокой частотой встречаемости, особенно в регионах со сложными климато-географическими условиями, клинической гетерогенностью симптоматики, прогредиентным характером течения, высокой эффективностью терапии на ранних стадиях развития патологического процесса.
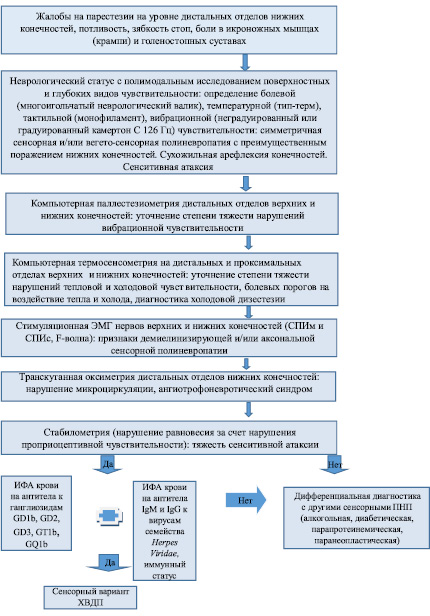
Рис. 11. Алгоритм первичной диагностики сенсорного варианта ХВДП на амбулаторно-поликлиническом этапе: ЭМГ – электромиография; СПИм – скорость проведения импульса по моторным волокнам; СПИс – скорость проведения импульса по сенсорным волокнам; ПНП – полиневропатия
Для ранней диагностики сенсорного варианта ХВДП нами рекомендуется проведение обследования согласно новому алгоритму, включающему назначение с целью скрининга доступных современных нейрофизиологических методов диагностики, таких как компьютерная паллестезиометрия, компьютерная термосенсометрия, стимуляционная ЭМГ, стабилометрия, транскутанная оксиметрия, которые в комплексе с полимодальным исследованием поверхностных и глубоких видов чувствительности, ИФА крови на антитела к ганглиозидам GD1b, GD2, GD3, GT1b, GQ1b и на антитела IgM и IgG к вирусам семейства Herpes Viridae, позволят не только верифицировать клинический диагноз, но и провести дифференциальную диагностику сенсорного варианта ХВДП с другими формами ПНП.
Библиографическая ссылка
Шнайдер Н.А., Попова Т.Е., Петрова М.М., Николаева Т.Я., Супонева Н.А., Газенкампф К.А., Кантимирова Е.А., Дюжакова А.В. НОВЫЙ ПОДХОД К НЕЙРОФИЗИОЛОГИЧЕСКОЙ ДИАГНОСТИКЕ СЕНСОРНОГО ВАРИАНТА ХРОНИЧЕСКОЙ ВОСПАЛИТЕЛЬНОЙ ДЕМИЕЛИНИЗИРУЮЩЕЙ ПОЛИНЕВРОПАТИИ С ИСПОЛЬЗОВАНИЕМ СОВРЕМЕННЫХ МЕДИЦИНСКИХ ТЕХНОЛОГИЙ // Международный журнал экспериментального образования. 2015. № 10-1. С. 76-87;URL: https://expeducation.ru/ru/article/view?id=8518 (дата обращения: 08.03.2026).

