Введение
Колоректальный рак (КРР) занимает одно из ведущих мест в структуре онкологической заболеваемости и смертности в развитых странах мира, выходя на третье место у мужчин и второе – у женщин [1, 6]. Рассматривая структуру заболеваемости раком среди мужского населения России, следует отметить, что злокачественные опухоли ободочной и прямой кишки занимают пятое и шестое место в общей статистике онкологических заболеваний. Суммарно, опухоли толстой и прямой кишки занимают второе место, уступая лишь раку легкого. Хирургия остается оптимальным методом лечения, поскольку диагностирование опухоли преимущественно на поздних стадиях заболевания требует оперативных и радикальных мер помощи пациенту в короткие сроки. Тем не менее, современные методы химиотерапии, направленные на уменьшение размеров опухоли, замедление опухолевого роста и предотвращение появления новых метастазов, не менее важны при лечении КРР.
Применение таргетных препаратов нового поколения, таких как моноклональные антитела к EGFR (Epidermal Growth Factor Receptor - рецептор эпидермального фактора роста) позволило увеличить общую выживаемость пациентов с метастатическим КРР при наличии у них дикого типа гена KRAS (v-Ki-ras2 Kirsten rat sarcoma viral oncogene homologue). Ген KRAS служит одним из звеньев сигнального пути EGFR-KRAS-BRAF-MEK-MAPK, регулирующего клеточную пролиферацию, ангиогенез, апоптоз и др. В случае КРР наиболее часто проявляются мутации гена KRAS в 12 и 13 кодонах, однако мутации в 61, 117 и 146 кодонах (менее 1%) также оказывают постоянный активирующий эффект на активность RAS белка. Результатом возникающей независимо от состояния EGFR постоянной активации сигнального пути EGFR-KRAS-BRAF-MEK-MAPK является нейтрализация эффекта блокирующих EGFR таргетных препаратов [2, 4, 10].
Изучению частоты мутаций гена KRAS и их связь с клининико-патологическими особенностями у пациентов с колоректальным раком были посвящены многочисленные исследования [1]. На Юге России подобные исследования ранее не проводились. Вместе с тем, население данной территории имеет свои популяционные особенности, что требует подробного изучения.
Цель исследования заключалась в изучении популяционного полиморфизма 7 SNP-мутаций соматического происхождения в гене KRAS опухолевых биоптатов пациентов с диагнозом КРР Юга России для адекватного назначения таргетных препаратов (цетуксимаб, панитумумаб). Определялась взаимосвязь обнаруженных мутаций с клинико-патологическими особенностями пациентов, получавших стационарное лечение в ФГБУ «Ростовский научно-исследовательский онкологический институт» Министерства здравоохранения Российской Федерации.
Пациенты и методы
В настоящее исследование было включено 168 пациентов (73 мужчины, 95 женщин) в возрасте от 28 до 89 лет с морфологически подтвержденным диагнозом аденокарциномы толстой или прямой кишки. Из фиксированных в 10%-м забуференном формалине и залитых в парафин образцов тканей опухолей получали срезы толщиной 8-10 мкм. Для молекулярно-генетического исследования использовали срезы, содержащие не менее 20% опухолевых клеток. Процедура экстракции ДНК включала в себя стандартную депарафинизацию срезов орто-ксилолом, отмывку 96-% этанолом, инкубирование при комнатной температуре в лизирующем буфере с протеиназой K в течение 12 часов и последующую инкубацию при температуре 900 в течение 1 часа. Затем образцы обрабатывали набором реагентов QIAamp® DNA FFPE Tissue Kit (QIAGENE, Германия) согласно протоколу производителя. Концентрацию выделенной из образцов ДНК измеряли на флюориметре Qubit 2.0® с использованием набора Quant-iT™ dsDNA High-Sensitivity (HS) Assay Kit (Invitrogen, США). Концентрация ДНК нормализовывалась до величины 1 нг/мкл. При помощи набора реагентов «Real-Time-PCR-KRAS-7M» («Биолинк», Россия) проводили определение 7 SNP-мутаций (Single Nucleotide Polymorphism) в 12 и 13 кодонах гена KRAS: G12C, G12S, G12R, G12V, G12D, G12A, G13D с использованием термоциклера Bio-Rad CFX96 (Bio-Rad, США).
Статистический анализ выполняли с использованием прикладных пакетов программ Microsoft Excel 2010 и STATISTICA 8.0. Определяли различия в группах, выделенных в соответствии с определенными признаками (пол, возраст, локализация первичной опухоли, степень дифференцировки опухолевых клеток, наличие метастазов в печень, регионарные и отдаленные лимфоузлы, стадия заболевания), у пациентов с мутантным и диким типом гена KRAS. Оценку различий проводили с использованием χ2-критерия, для уровня статистической значимости р<0,05.
Результаты и обсуждение
Согласно данным клинических экспериментальных исследований, соматические мутации гена KRAS в опухолях толстого кишечника различных популяций очень вариабельны и встречаются от 30 до 60% случаев [1, 9]. Например, у афроамериканцев частота мутаций в гене KRAS составила 30,9% (n=222), у японцев – 37,6% (n=5790), у немцев – 49% (n=820), у итальянцев – 38,4% (n=107), у корейцев – 35,4% (n=82) соответственно. В исследованной нами группе пациентов c КРР I-IV стадии (n=168) мутации в 12 и 13 кодонах гена KRAS были обнаружены в 38,7% (n=65) случаев.
В ряде исследований, анализировавших связь между такими клинико-патологическими особенностями, как возраст, пол, локализация опухоли, глубина инвазии, наличие регионарных, или отдаленных метастазов, степень злокачественности, инвазия в сосудистое русло, размер опухоли статистически значимых отличий в проявлениях мутантного или дикого типов гена KRAS не было обнаружено [3]. Однако имеются данные о том, что мутантный ген KRAS чаще встречается в опухолях ректосигмоидного отдела и прямой кишки, чем в вышележащих отделах. [1]. Ассоциации между мутациями гена KRAS и различными клинико-патологическими особенностями пациентов представлены во многих исследованиях. Результаты проведенного нами исследования на Юге России свидетельствует о статистически значимой более высокой частоте проявления мутаций в гене KRAS при КРР у женщин по сравнению с мужчинами, а также более высокий уровень мутаций в гене KRAS при наличии метастазов в регионарные лимфоузлы (p<0,05). Кроме того, близки к статистически значимым различия в группах пациентов старшего возраста и с поздними стадиями заболевания (табл.1). Статистически значимых ассоциаций наличия мутантного типа гена KRAS в группах пациентов в зависимости от локализации первичной опухоли, степени дифференцировки опухолевых клеток, наличия метастазов печень и отдаленные лимфоузлы в данном исследовании не обнаружено. Тем не менее, в некоторых работах присутствуют данные о взаимосвязи между мутациями KRAS и клинико-морфологическими признаками.
Таблица 1
Ассоциация наличия мутаций в гене KRAS и клинико-патологических характеристик пациентов с колоректальным раком (КРР)
|
Характеристика |
Общее число пациентов, n=168 (%) |
Статус гена KRAS |
Значение критерия χ2 |
Значение p, статистическая значимость p<0,05 |
|
|
Дикий тип, n=103 (61,3%) |
Мутантный тип, n=65 (38,7%) |
||||
|
Пол |
|||||
|
Мужчины |
73 (43,5%) |
51 (69,8%) |
22 (30,2%) |
3,98 |
0,046 значимо |
|
Женщины |
95 (56,5%) |
52 (54,7%) |
43 (45,3%) |
||
|
Возраст |
|||||
|
≤ 55 лет |
59 (35,1%) |
42 (71,2%) |
17 (28,8%) |
3,74 |
0,053 не значимо |
|
> 55лет |
109 (64,9%) |
61 (55,9%) |
48 (44,1%) |
||
|
Локализация первичной опухоли |
|||||
|
Проксимальные отделы ТК |
50 (29,7%) |
30 (60%) |
20 (40%) |
0,05 |
0,8205 не значимо |
|
Дистальные отделы ТК, в т.ч. прямая кишка |
118 (70,3%) |
73 (61,8%) |
45 (38,2%) |
||
|
Дифференцировка опухолевых клеток* |
|||||
|
G2 |
143 (85,1%) |
87 (60,8%) |
56 (39,2%) |
0,09 |
0,7647 не значимо |
|
G3 |
25 (14,9%) |
16 (64%) |
9 (36%) |
||
|
Метастазы в печень |
|||||
|
Есть |
77 (45,8%) |
47 (61%) |
30 (39%) |
0,01 |
0,8939 не значимо |
|
Нет |
91 (54,2%) |
56 (61,5%) |
35 (38,5%) |
||
|
Метастазы в регионарные лимфоузлы |
|||||
|
Есть |
74 (44%) |
43 (58,1%) |
31 (41,9%) |
1,48 |
0,046 значимо |
|
Нет |
60 (56%) |
41 (68,3%) |
19 (31,7%) |
||
|
Метастазы в отдаленные лимфоузлы |
|||||
|
Есть |
40 (23,8%) |
25 (62,5%) |
15 (37,5%) |
0,03 |
0,8594 не значимо |
|
Нет |
128 (76,2%) |
78 (60,9%) |
50 (39,1%) |
||
|
Стадия |
|||||
|
I+II |
33 (19,6%) |
25 (75,7%) |
8 (24,3%) |
3,61 |
0,0573 не значимо |
|
III+IV |
135 (80,4%) |
78 (57,7%) |
57 (42,3%) |
||
*В настоящем исследовании опухоли высокой степени дифференцировки (G1) не наблюдались.
Так, в популяциях пациентов с КРР раком в Швейцарии (n=404) и Турции (n=53) ассоциаций с возрастом, полом и дифференцировкой опухолевых клеток не выявлено, но показана связь между мутациями 13 кодона гена KRAS и стадиями развития заболевания по классификации Дьюка. Согласно другим данным, в том числе и нашего исследования, имеется связь мутаций гена KRAS с полом и наличием регионарных метастазов [7, 8, 9].
В проведенном исследовании в опухолях с мутантным типом гена KRAS (n=65) преобладающим типом мутаций оказались транзиции (69,2%), т.е. замены по типу «пуриновое основание на пуриновое» или «пиримидиновое основание на пиримидиновое», а на долю трансверсий пришлось соответственно 30,8%. (рис.1, табл. 2). Среди SNP-мутаций в 12 и 13 кодонах в обследованной группе наиболее часто встречались - G12D (32,7%) и G13D (24,7%).
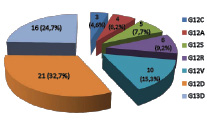
Рис.1. Частота различных мутаций в гене KRAS (12, 13 кодоны) у пациентов с КРР
на Юге России
Таблица 2
Анализируемые SNP-мутации в 12 и 13 кодонах гена KRAS
|
Мутация |
Тип |
Результирующая замена аминокислоты |
|
G12C |
Транзиция |
глицин→цистеин |
|
G12A |
Трансверсия |
глицин→аланин |
|
G12S |
Транзиция |
глицин→серин |
|
G12R |
Трансверсия |
глицин→аргинин |
|
G12V |
Трансверсия |
глицин→валин |
|
G12D |
Транзиция |
глицин→аспарагиновая кислота |
|
G13D |
Транзиция |
глицин→аспарагиновая кислота |
Результатами многих исследований показано, что наиболее часто встречающимися SNP-мутациями при КРР являются транзиции (мутации G12D и G13D) с результирующей заменой глицина на аспарагиновую кислоту в белковой последовательности [3]. Среди пациентов с КРР на Юге России мутации G12D и G13D также встречаются чаще других мутаций (рис.1). Известно, что транзиции могут происходить спонтанно в результате ошибок репликации ДНК под действием пищевых генотоксических агентов и химических модификаций азотистых оснований . Также имеются сведения о влиянии профессиональных вредностей и курения на возникновение мутаций в 13-го кодоне гена KRAS [5].
Заключение
В проведенном исследовании впервые определена частота мутаций гена KRAS у пациентов с КРР на Юге России (38,7%), которая близка по своему значению к среднеевропейской (~40%). Больные с КРР нуждаются в определении статуса мутаций гена KRAS, играющего важную роль в плане дальнейшей стратегии химиотерапевтического лечения. Так, например, при наличии мутации в 13 кодоне возможно эффективное сочетанное применение традиционной химиотерапии с таргетными препаратами. В проведенном нами исследовании частота мутаций G13D составляет практически четвертую часть среди всех анализируемых изменений. Данная группа пациентов потенциально может получать таргетную терапию в сочетании с традиционной химиотерапией [9]. Выявленные ассоциации мутаций гена KRAS c клинико-патологическими особенностями позволяют с большей вероятностью ожидать мутации гена KRAS у женщин и при наличии регионарного метастазирования в лимфатические узлы. Также очень высока вероятность обнаружения мутаций в гене KRAS (12, 13 кодоны) у пациентов старше 55 лет (более чем на 50%) и на 3-4 стадиях развития онкологического процесса (более чем на 75%). Проведение молекулярно-генетического исследования среди пациентов с КРР позволило более полно охарактеризовать популяцию, проживающую на Юге России по частотам различных видов SNP-мутаций гена KRAS.
Библиографическая ссылка
Водолажский Д.И.,1Антонец А.В., Двадненко К.В., Владимирова Л.Ю., Геворкян Ю.А., Касаткин В.Ф., Максимов А.Ю. СВЯЗЬ МУТАЦИЙ ГЕНА KRAS С КЛИНИКО-ПАТОЛОГИЧЕСКИМИ ОСОБЕННОСТЯМИ КОЛОРЕКТАЛЬНОГО РАКА У ПАЦИЕНТОВ ЮГА РОССИИ // Международный журнал экспериментального образования. 2014. № 1-1. С. 65-68;URL: https://expeducation.ru/ru/article/view?id=4517 (дата обращения: 23.12.2025).

